En medicina, toda terapia presupone la existencia de una enfermedad. ¿Está enfermo el conocimiento clínico? Es decir, ¿requiere el conocimiento científico sobre la efectividad de las intervenciones médicas una terapia? La respuesta es afirmativa, como intentaremos argumentar, y se manifiesta en tres dimensiones críticas: su fiabilidad, su aplicabilidad y su relevancia. El problema no es metodológico, sino profundamente epistémico; es decir, filosófico.
La fiabilidad del conocimiento clínico
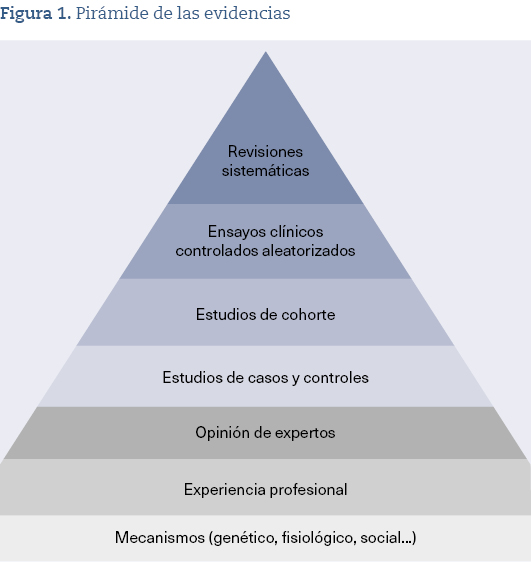
En el marco de la medicina basada en la evidencia (MBE), los ensayos clínicos aleatorizados (ECA) y las herramientas de síntesis del conocimiento —como las revisiones sistemáticas y los metanálisis— son considerados el gold standard en la producción de evidencia clínica. Este conjunto metodológico constituye el ápex jerárquico en la pirámide de la evidencia (figura 1) y orienta las decisiones tanto con pacientes individuales como para el desarrollo de guías de práctica clínica (GPC) y políticas sanitarias1.
En las últimas décadas, hay una creciente preocupación ya que una proporción significativa del conocimiento biomédico publicado es poco fiable, por parcial o sesgado. Chalmers y Glasziou estimaron que más del 85% de los recursos destinados a investigación médica se desperdician debido a que no responden a preguntas clínicamente relevantes y deficiencias evitables en su diseño, conducción, análisis y publicación2.
En su revisión crítica, Stamatakis et al.3 documentan cómo las corporaciones farmaceúticas y tecnológicas ejercen un control sustancial, mediante la financiación y dinámicas intensivas de marketing e influencia, en el diseño y los resultados de la investigación médica, así como sobre los procesos vinculados de difusion (GPC, publicaciones científicas, formación médica) y aplicación del conocimiento. Ioannidis argumentó que la mayoría de los hallazgos en investigación médica, especialmente en contextos de alta complejidad y existencia de conflictos de interés, tienen un elevado riesgo de ser falsos o exagerados, considerando la mayoría de los diseños de investigación y la mayoría de los campos4. La flexibilidad analítica, el p-hacking y la formulación de hipótesis post hoc son prácticas frecuentes que comprometen la validez interna de muchos estudios.
El filósofo de la ciencia, Jacob Stegenga, en su obra Medical Nihilism5, argumenta que existe una tendencia sistemática a sobrestimar los beneficios y subestimar los daños en las evidencias sobre intervenciones médicas. Dado el historial de exageraciones, errores y conflictos de interés existentes en medicina, debemos adoptar una actitud de «nihilismo médico moderado» ante muchas de las afirmaciones sobre efectividad terapéutica. Stegenga analiza las decisiones metodológicas de «grano fino», aquellas que se toman durante el diseño, desarrollo y análisis de los estudios, aparentemente técnicas o neutras, pero con consecuencias profundas sobre los resultados.
Estos datos apuntan a que la investigación clínica médica actual enfrenta desafíos estructurales que comprometen la fiabilidad del conocimiento utilizado en la clínica. Más allá de dificultades metodológicas aisladas, los problemas de fiabilidad están condicionados por una deriva institucional6 o proceso mediante el cual las instituciones sanitarias, originalmente creadas con fines de protección y beneficio para la sociedad, se alejan progresivamente de sus objetivos primarios, adoptando prácticas, normas o dinámicas que favorecen intereses ajenos —sobre todo comerciales o corporativos— en detrimento del interés del paciente o del bien común.
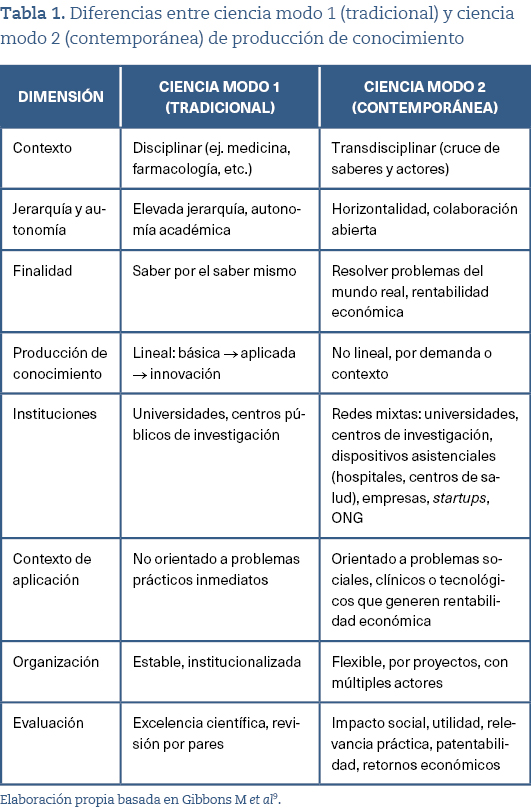
Las razones de esta situación son políticas7. El cambio fundamental se produjo en la década de los años ochenta del pasado siglo. La llamada revolución neoliberal protagonizada por Reagan y Thatcher tuvo su correlato en los procesos de producción del conocimiento científico en lo que Echeverría llama «revolución tecno-científica»8, y Gibbons et al.9, «ciencia modo 2» (tabla 1).
Este proceso de cambio profundo en los objetivos, forma de producción y criterios de evaluación de la ciencia suposo una indudable dinamización de la innovación. Basado en modelos empresariales y de emprendimiento, la monetización de los productos, su patentabilidad y los retornos económicos se convierten en elementos de evaluación igual o más importantes que la eficacia terapéutica, y el marketing pasa a tener un papel fundamental en toda la cadena de producción. Tras casi 40 años de profundización en el modelo tecno-científico, los graves problemas con la fiabilidad del conocimiento evidencian la incapacidad de las agencias reguladoras10 y las instituciones médicas para revertir las inercias inherentes a su propio diseño.
Si el origen es político, las soluciones también deben serlo. Recientemente, un grupo de destacados investigadores11 proponían algunas soluciones. Alianzas entre organizaciones profesionales y de la sociedad civil como No Es Sano12, hacen abogacía por cambiar el modelo de innovación y financiación de los medicamentos y tecnologías (tabla 2).
Aplicabilidad del conocimiento a la clínica
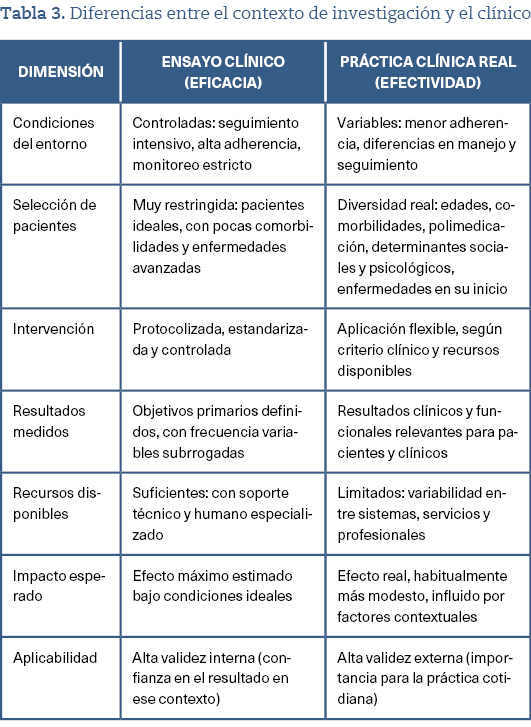
Una vez que tenemos un conocimiento fiable, es necesario que sea aplicable. Sin embargo, aplicar (extrapolar o inferir) un conocimiento obtenido en un contexto experimental a un paciente concreto require un salto epistémico que debe ser reflexionado (tabla 3).
La ortodoxia de la MBE ha resuelto el problema de la aplicabilidad con la regla heurística que Stegenga llama «extrapolación simple, excepto» (ESE). Por ejemplo, David Sacket en el libro fundacional de la MBE13, escribe: «La validez externa se evalúa comparando los pacientes del ensayo con los propios. Si tu paciente es tan diferente de los del ensayo que hay una razón de peso para esperar una respuesta distinta al tratamiento, deberías ser cauteloso al aplicar los resultados. De lo contrario, adelante».
Para Stegenga, este es un enfoque epistemológicamente débil por ser demasiado optimista y reduccionista. Argumenta que: (1) la evidencia de eficacia no se traduce de manera automática en efectividad; (2) los ECA están diseñados para minimizar el ruido, no para capturar la complejidad del contexto clínico; (3) la heurística ESE ignora que, en muchos casos, no tenemos buenas razones para aceptar ni rechazar la extrapolación, lo que introduce un sesgo estructural optimista; (4) promueve una visión mecanicista y simplificada de la causalidad médica, como si las intervenciones tuvieran efectos constantes e independientes del contexto. La regla ESE aparece como la norma por defecto y la cautela es la excepción condicional.
Lo cierto es que el llamado «sesgo de reclutamiento», cuyo objetivo es mejorar la validez interna del estudio, reduce proporcionalmente la validez externa y, por tanto, la aplicabilidad, al excluir a grupos de población que posteriormente recibirán los tratamientos como ancianos, mujeres, pacientes con comorbilidades o con tratamientos concomitantes14-16.
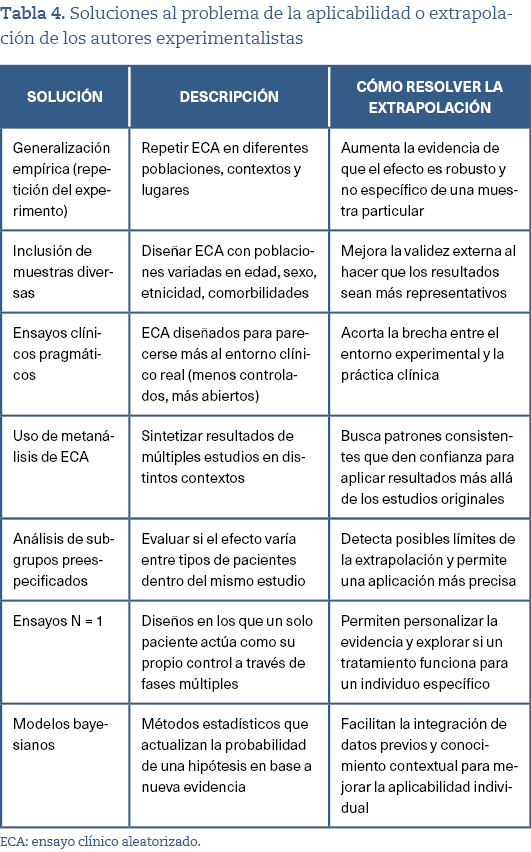
Howick reconoce el problema de la aplicabilidad de los resultados de los ECA a los contextos particulares, pero defiende que otros modelos de extrapolación están sometidos a más sesgos como el de confirmación, la ilusión de causalidad o los errores sistemáticos17. Ioannidis advierte contra la inferencia no justificada y llama a una mayor transparencia, replicación y análisis de subgrupos para mejorar la aplicabilidad de la evidencia18. En la tabla 4 podemos ver algunas soluciones por parte de los investigadores que con matices defienden el marco jerárquico de la MBE y que Julian Reiss denomina «experimentalistas»19.
Stegenga5 considera que el problema de la extrapolación es más profundo y estructural y que ni reglas metodológicas ni ajustes estadísticos pueden realmente superar la incertidumbre que supone trasladar resultados de ECA a contextos clínicos. Muchos tratamientos presentan efectos clínicos modestos y se sustentan en datos de baja calidad, lo que puede conducir a extrapolaciones inadecuadas y a una amplificación de la incertidumbre. Critica la insuficiente consideración de la variabilidad biológica interindividual, un factor clave en la respuesta terapéutica, y subraya la tendencia a subestimar el impacto de las interacciones contextuales —sociales, psicológicas y ambientales— sobre los resultados clínicos.
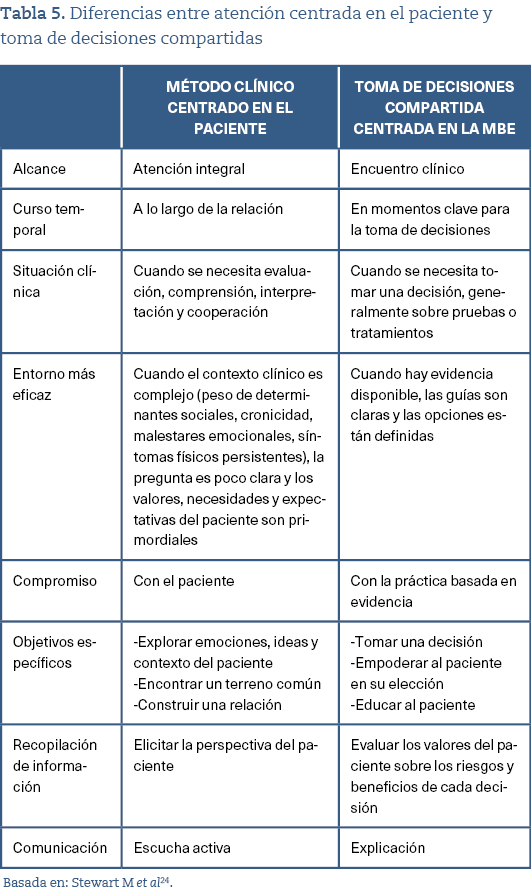
Las sucesivas conceptualizaciones de la MBE han incorporado, al menos en el plano teórico, elementos como el juicio profesional, las circunstancias clínicas particulares de los pacientes, sus valores, preferencias y consideraciones económicas, como variables a considerar en la toma de decisiones20. La llamada «toma de decisiones compartida»21-23 que se ha desarrollado desde el marco de la MBE, es útil cuando existen opciones claramente definidas y evidencia robusta, es decir, en contextos donde los objetivos están centrados en una enfermedad específica y en decisiones puntuales sobre pruebas o tratamientos. Sin embargo, cuando las decisiones clínicas son más complejas o inciertas, el modelo no proporciona orientaciones sobre cómo integrar de manera equilibrada los valores, experiencias y contexto del paciente con las evidencias. En la tabla 5 podemos ver las diferencias entre un modelo de toma de decisiones centrado en el paciente y otro de toma compartida de las decisiones centrado en las evidencias24. La consecuencia es que, en la mayoría de las circunstancias, la evidencia tiende a prevalecer sobre los demás factores.
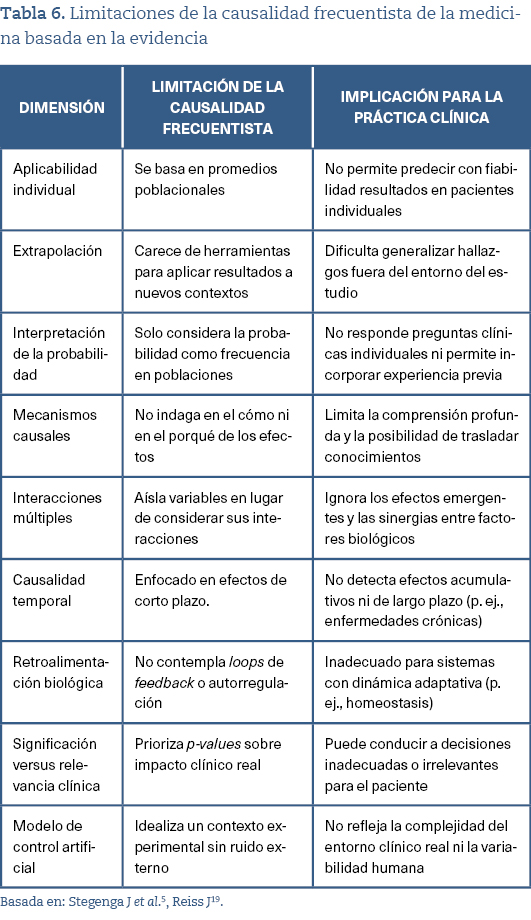
El modelo clínico propuesto por la MBE no ofrece un marco realista ni estructurado para la integración efectiva de los otros elementos del juicio, operando más como una forma encubierta de prescripción normativa20. Lejos de favorecer el razonamiento clínico, la MBE tiende a perpetuar una práctica centrada en el profesional sustentada por una evidencia estandarizada, sin contemplar de forma adecuada la complejidad inherente al proceso de toma de decisiones clínicas especialmente en condiciones de máxima incertidumbre (falta de diagnóstico claro, evidencias inexistentes, contradictorias o no robustas, pacientes con enfermedades crónicas o pluripatología, síntomas físicos persistentes, malestares emocionales, intervenciones preventivas de base individual, etc.)25. Entre las razones de estas limitaciones, se encuentra el marco frecuentista de causalidad que propone la MBE, incapaz de captar la complejidad no lineal y multifactorial de los procesos biológicos5,19 (tabla 6).
Una propuesta teórica particularmente consistente es la desarrollada por Nancy Cartwright26, quien argumenta que el mundo no está regido por completo por leyes científicas universales, sino que constituye una configuración heterogénea —o «moteada»— de orden y desorden. Según esta perspectiva, las leyes científicas muestran una aplicabilidad robusta solo en contextos altamente controlados, como los entornos de laboratorio o los ECA, mientras que fuera de ellos tienden a fragmentarse, volviéndose locales y dependientes de condiciones contextuales específicas. Esta crítica resulta especialmente pertinente en el ámbito médico, donde la pretensión de generalización de los hallazgos de los ECA ignora la complejidad ontológica y causal de los fenómenos clínicos reales. Frente al reduccionismo causal frecuentista de la MBE, la propuesta de Cartwright ofrece un marco conceptual más realista y situado, que reconoce la necesidad de interpretar la causalidad desde una lógica contextual y no meramente estadística.
En colaboración con el premio nobel de economía Angus Deaton27, Nancy Cartwright ha defendido un enfoque pluralista de la evidencia y una visión acumulativa del conocimiento científico (cumulative science), donde los ECA no son considerados superiores a otras fuentes de conocimiento como estudios observacionales, cualitativos, análisis de casos, mecanismos y modelos teóricos. Este enfoque pone énfasis en la comprensión del contexto, argumentando que la extrapolación de resultados debe basarse en un conocimiento profundo de las condiciones locales de aplicación y en la descripción de los mecanismos causales subyacentes a las intervenciones, y no solo en la fuerza estadística del diseño experimental28. En ausencia de un conocimiento contextual y de los mecanismos causales29, cualquier intento de extrapolación resulta epistemológicamente débil y clínicamente incierto.
Esta perspectiva reivindica el papel fundamental del juicio clínico y de la deliberación racional como componentes esenciales para integrar las distintas fuentes de conocimiento en la práctica médica. En consecuencia, cuestiona el concepto tradicional de jerarquía de las evidencias. Según Cartwright y Deaton, la conocida pirámide de evidencias (figura 1) resulta metodológicamente inadecuada por varias razones. En primer lugar, la calidad de la evidencia no está determinada de forma exclusiva por el método utilizado, sino también por su pertinencia respecto al problema clínico que se intenta resolver. En segundo lugar, la causalidad es intrínsecamente contextual y no puede ordenarse de manera jerárquica: la inferencia causal no mejora necesariamente mediante la aplicación de un método que se supone superior, sino a través de la construcción de un conocimiento acumulativo basado en un pluralismo evidencial. Finalmente, advierten que el rigor técnico —representado en la cúspide de la pirámide— no debe confundirse con autoridad epistémica, ya que esta última exige una articulación crítica y contextual del conocimiento.
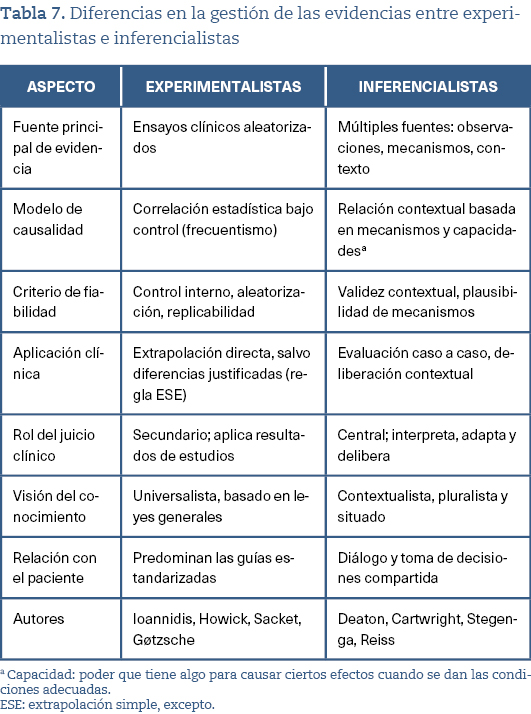
El modelo evidencial defendido por autores como Cartwright, Deaton, Reiss o Stegenga —de carácter pluralista y complejo— se ajusta de manera más adecuada a la realidad clínica al partir de una concepción contextual, flexible y deliberativa del conocimiento. Este enfoque refleja con mayor fidelidad las condiciones en las que los profesionales de la salud toman decisiones en la práctica30-32. En contraste con la rigidez de la jerarquía tradicional de las evidencias, esta propuesta permite: (1) movilizar diversas fuentes de conocimiento en función del problema clínico y de las circunstancias específicas, superando la desconexión entre rigor metodológico y pertinencia práctica; (2) reconocer el juicio clínico como un componente esencial para interpretar y aplicar la evidencia, especialmente en contextos de incertidumbre o cuando los datos disponibles entran en tensión con las particularidades del paciente; (3) incorporar la complejidad y heterogeneidad de los pacientes reales, quienes a menudo presentan múltiples comorbilidades, están influidos por determinantes sociales y manifiestan preferencias individuales, y (4) asumir de manera explícita la incertidumbre inherente a la práctica médica. A los defensores de esta visión epistémica se les ha denominado inferencialistas19. En la tabla 7 se resumen las principales diferencias entre el enfoque experimentalista y el inferencialista.
Si bien el modelo contextual y pluralista ofrece una base sólida para abordar la complejidad de la causalidad en medicina, esto no implica descartar por completo el valor de heurísticos simples como el de la extrapolación directa o ESE. Tal como argumenta Gigerenzer en su teoría de la heuristic decision making33, en entornos caracterizados por alta incertidumbre y limitaciones de tiempo, cognitivas o informacionales, las heurísticas pueden ser herramientas efectivas para la toma de decisiones. No todas las decisiones requieren un análisis exhaustivo contextual. En situaciones donde existe una alta eficacia demostrada —por ejemplo, cuando los ensayos clínicos arrojan un número necesario a tratar (NNT) bajo— y el escenario clínico es agudo y monocausal, la extrapolación puede ser una herramienta válida. Por ejemplo, la estreptoquinasa en el infarto agudo de miocardio, antibióticos betalactámicos en la neumonía neumocócica comunitaria, la naloxona en casos de sobredosis por opioides o intervenciones de prevención secundaria cardiovascular. En estos casos, la relación causa-efecto está suficientemente documentada, el beneficio clínico es inmediato o cercano y sustancial, y la heterogeneidad interindividual tiene un impacto limitado en la efectividad del tratamiento. En tales escenarios, el recurso a la extrapolación directa o heurístico ESE puede ser una forma eficiente y justificada de toma de decisiones, sin que ello implique renunciar al juicio clínico o a la evaluación crítica de cada caso. Lamentablemente, en medicina no existen demasiadas situaciones donde el heurístico ESE pueda ser activado con seguridad.
Por el contrario, en contextos clínicos donde los ensayos han demostrado beneficios marginales —reflejados, por ejemplo, en un NNT mayor de 25—, la aplicación automática del heurístico ESE se vuelve problemática. Este es el caso, por ejemplo, de la inmensa mayoría de las intervenciones de prevención primaria cardiovascular. Aunque estadísticamente significativos, los efectos de estas intervenciones suelen ser pequeños y muy sensibles al contexto individual.
La situación se vuelve aún más compleja en enfermedades crónicas de etiología múltiple o en dolencias de difícil categorización, como síntomas somáticos persistentes o malestares emocionales inespecíficos. En estos escenarios, la causalidad es difusa, la respuesta al tratamiento es variable y la influencia de factores sociales, psicológicos y biográficos es determinante. Ante esta complejidad, el modelo pluralista y contextual no solo se justifica, sino que se vuelve indispensable, al ofrecer un marco flexible que reconoce la incertidumbre y da centralidad al juicio clínico y a la deliberación situada.
En suma, la reflexión sobre la aplicabilidad de los ensayos clínicos y sus instrumentos de síntesis al contexto clínico que nos ha llevado al debate entre experimentalistas e inferencialistas refleja dos concepciones distintas del conocimiento clínico y de su aplicación práctica. Lejos de ser opuestas, ambas aproximaciones pueden entenderse como complementarias en función del problema clínico, contribuyendo a una práctica médica más reflexiva, realista y orientada al paciente.
Relevancia del conocimiento
Fiabilidad y aplicabilidad son cualidades propias del conocimiento entendido como medio, es decir, como instrumento para atender la enfermedad. Sin embargo, al hablar de relevancia, nos situamos en el plano de los fines. El conocimiento será relevante «para alguien» en la medida que contribuya al fin último de la atención sanitaria que es la salud. Por ello, la relevancia del conocimiento clínico no puede establecerse sin una definición previa y compartida de salud.
El concepto de salud ha sido objeto de múltiples definiciones a lo largo del tiempo, cada una con implicaciones normativas y prácticas distintas. La definición clásica de la Organización Mundial de la Salud (OMS) de 1948 la describe como «un estado de completo bienestar físico, mental y social, y no solamente la ausencia de afecciones o enfermedades». Aunque ambiciosa y progresista para su época, esta formulación ha sido criticada por su carácter utópico y su difícil operatividad en contextos clínicos reales. En contraste, una visión más restringida —pero ampliamente utilizada en la práctica biomédica— entiende la salud como la simple ausencia de enfermedad34, una concepción negativa que reduce el fenómeno de la salud a parámetros biomédicos y deja fuera dimensiones fundamentales como la funcionalidad, la adaptación o el bienestar subjetivo. Más recientemente, ha ganado protagonismo la noción de salud como capacidad35,36. Según esta perspectiva, una persona está sana en la medida en que puede realizar las funciones y actividades que valora en su vida, independientemente de la presencia de una enfermedad diagnosticada. Esta concepción introduce un enfoque más funcional, dinámico y centrado en la persona, permite poder considerar sana a una persona con enfermedad crónica —si ha desarrollado recursos y habilidades para poder enfrentarse a las demandas de la vida cotidiana— y considerar enferma a una persona con dolencias limitantes, aunque no impliquen alteraciones biológicas, como pasa con los síntomas físicos persistentes (por ejemplo, fibromialgia, colon irritable, etc.).
Concebir la salud como capacidad implica asumir que el valor del conocimiento en el ámbito clínico no reside solo en su validez científica, sino en su pertinencia para promover la vida que el paciente valora. Bajo esta perspectiva, la relevancia de la información biomédica, los tratamientos o las recomendaciones clínicas no es intrínseca, sino que depende de su contribución al proyecto de vida del paciente, es decir, a su capacidad de funcionar, adaptarse y perseguir fines significativos en su contexto. Esto exige un cambio en la relación clínica: el profesional sanitario ya no es solo un transmisor de saber experto, sino un acompañante en la construcción compartida de decisiones37. Solo a través del diálogo entre ambos se puede determinar qué conocimientos son relevantes, esto es, realmente útiles para promover la salud entendida como capacidad.
Este enfoque es apuntalado por nuevas perspectivas en el estudio de la salud y la enfermedad que evidencian que su expresión no puede comprenderse únicamente a partir de factores biológicos aislados, sino que emerge de la interacción compleja de múltiples dimensiones, incluidas las variables psicológicas, sociales y ambientales38. Desarrollos recientes en campos como la medicina de redes39, la teoría de sistemas complejos adaptativos aplicados a la salud40 y la psiconeuroinmunología41 han permitido identificar los mecanismos mediante los cuales estas dimensiones se interrelacionan. Se conoce mejor, de igual modo, cómo impacta la calidad de la relación clínica en resultados clínicos tradicionalmente considerados objetivos o biológicos. Varios estudios han demostrado que un vínculo terapéutico caracterizado por la empatía y la compasión puede influir en la evolución de enfermedades infecciosas, reducir la percepción del dolor y disminuir la necesidad de anestesia durante procedimientos quirúrgicos42. También la capacidad de la relación clínica para mejorar dolencias que se resisten a los enfoques biomédicos, como los síntomas físicos persistentes43 o el dolor crónico44.
Las nuevas definiciones de salud, centradas en la capacidad de las personas para adaptarse y autogestionarse, junto con las teorías complejas que conciben la salud y la enfermedad como estados dinámicos emergentes de múltiples interacciones, nos confrontan con una exigencia clave: la necesidad de individualizar la atención sanitaria. En este marco, el conocimiento biomédico general —aunque indispensable— resulta insuficiente si no se contextualiza en la realidad única de cada paciente. La relevancia del conocimiento tiene que ver con su capacidad para generar sentido, utilidad y respuestas adaptadas a los contextos vitales concretos. Esto implica transformar el modelo asistencial hacia un enfoque más personalizado, relacional y flexible, donde las decisiones clínicas integren la singularidad biológica, biográfica, social y emocional del paciente como parte inseparable del proceso de cuidado. Esta propuesta encuentra un sólido respaldo en la práctica clínica generalista45,46.
Conclusiones
En este artículo se ha argumentado que el conocimiento clínico solo podrá responder de forma adecuada a los desafíos actuales si logra mejorar simultáneamente su fiabilidad, su aplicabilidad y su relevancia. Para ello, se propone una terapia epistémica del conocimiento clínico, entendida como un conjunto de estrategias orientadas a revisar críticamente las formas en que producimos, extrapolamos e interpretamos dicho saber. Esta terapia epistémica se concreta en tres dimensiones complementarias. Una terapia democrática, orientada a fortalecer la fiabilidad mediante una producción de conocimiento más plural, participativa y transparente. Una terapia contextual, que favorezca la aplicabilidad al integrar el saber clínico en los escenarios reales de la práctica, atendiendo a sus condicionantes sociales, organizativos y materiales. Y una terapia interpretativa, que potencie la relevancia al situar el conocimiento en diálogo con la experiencia vivida de cada paciente, reconociendo su singularidad biológica, biográfica, social, emocional y ambiental.
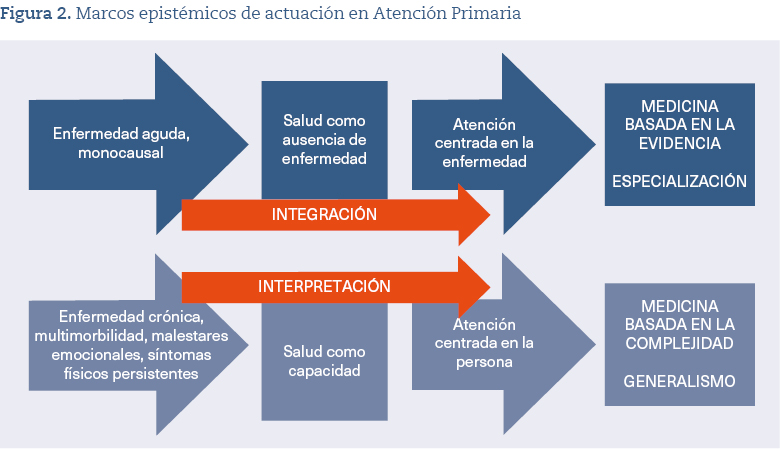
Este texto está especialmente dirigido a quienes ejercen la asistencia en el ámbito de la Atención Primaria (AP), donde la complejidad decisional es máxima. La tarea reflexiva propuesta, en lo que respecta a la aplicabilidad y relevancia del conocimiento, tiene como condición necesaria una práctica generalista desde AP. La figura 2 resume los dos marcos epistémicos dominantes que coexisten en la atención sanitaria y entre los cuales los y las profesionales de AP deben desplazarse según la naturaleza del problema de salud.
Cada uno de estos marcos epistémicos propone una forma distinta de comprender la enfermedad, la salud y el cuidado, y plantea al conjunto de profesionales de AP desafíos específicos. En el marco superior, se requiere integrar el conocimiento biomédico en el contexto particular de la persona; en el inferior, interpretar los síntomas desde una perspectiva relacional y biográfica. Cuando se trata de enfermedades agudas, bien definidas y con una causa clara, el objetivo es utilizar el conocimiento biomédico —derivado de la MBE y la especialización— dentro del contexto vital y clínico de la persona. La tarea principal es asegurar que las evidencias se usen de forma adecuada, cuidadosa y pertinente a cada situación individual, considerando elementos que, por ejemplo, puedan influir en la adherencia o que supongan un riesgo de efectos secundarios por interacciones farmacológicas.
En situaciones más complejas —como enfermedades crónicas, la multimorbilidad, malestares emocionales o síntomas persistentes—, entra en juego el marco epistémico inferior. Aquí, la salud se entiende como una capacidad, y la atención se centra en la persona. La labor se vuelve entonces principalmente interpretativa: no basta con seguir protocolos, aunque se hayan integrado. Es necesario dialogar con la historia de vida, los valores y las experiencias de quien consulta para construir de forma conjunta el sentido clínico de los síntomas y de las decisiones que hay que tomar. Esta capacidad de alternar entre marcos, asumiendo tanto funciones integradoras como interpretativas, constituye uno de los pilares esenciales de la práctica generalista y refleja su enorme potencial para abordar la complejidad inherente a la asistencia médica.
Agradecimientos
Agradecimientos a Sergio Minué, Carlos Coscollar, Gemma Torrell y Juan Antonio Sánchez por sus comentarios.
Consideraciones
Declaración de uso de inteligencia artificial: Parte del texto de este artículo fue redactado y/o editado con la asistencia de una herramienta de inteligencia artificial (ChatGPT, desarrollada por OpenAI). Su uso se limitó a la mejora del estilo académico, colaboración en la elaboración de las tablas y diseño de la figura 1. Todo el contenido fue revisado, corregido y aprobado por el autor, quien asume plena responsabilidad por su precisión y originalidad.
Conflicto de intereses
El autor de este artículo declara no tener ningún conflicto de intereses.