La pandemia por SARS-CoV-2 a principios del año 2020 ha supuesto un shock para todos los sistemas de salud y profesionales de la sanidad. Se trata de un virus nuevo que está causando una pandemia a nivel mundial y hay muy pocas referencias de cómo hacerle frente clínica y farmacológicamente. Esta circunstancia ha producido un alud de fármacos potencialmente beneficiosos que con el tiempo han demostrado escasa o nula eficacia1-3. Tras un período estival de cierta normalización, se produjo una segunda y tercera ola de nuevos contagios y la colchicina se posicionó, como ocurrió con la hidroxicloroquina, sin bibliografía que lo respaldara, como una opción prometedora para el tratamiento de la COVID-19.
La colchicina es un fármaco ampliamente utilizado en los ataques agudos de gota y de la gota crónica, profilaxis de ataques agudos por inicio del tratamiento con movilizadores del ácido úrico y enfermedad periódica (fiebre mediterránea familiar). En los últimos años, la colchicina a dosis bajas y fuera de las indicaciones recogidas en la ficha técnica se está utilizando como adyuvante al uso de un antinflamatorio no esteroideo (AINE) o un corticosteroide en los casos de pericarditis aguda y, sobre todo, de pericarditis recurrente4.
La base molecular y el supuesto mecanismo de acción inmunomodulador y antinflamatorio de la colchicina en la fase inflamatoria de la infección por SARS-CoV-2 es su efecto sobre las citoquinas5,6.
Mecanismos de acción que justificarían su uso en la COVID-19:
- Inhibición de NLRP3 o inflamasoma (pro IL1 o ILb).
- Inhibición de citoquinas: IL-6, TNF-a, PCR.
- Inhibición de moléculas de adhesión células T y endoteliales, migración monocitos.
- Inhibición de polimerización de microtúbulos, que conlleva inhibición plaquetaria y prevención de la trombosis.
La colchicina es un fármaco de estrecho margen terapéutico y en casos de sobredosificación presenta graves problemas de seguridad que la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recogió en una nota en el año 20107. Se pueden producir diferentes síntomas gastrointestinales, seguido de fallo multiorgánico. Se recomienda tener en cuenta la función renal para la dosificación de colchicina. Se desaconseja su uso concomitante con azitromicina (antibiótico muy utilizado en este tipo de pacientes), ya que se pueden aumentar los niveles plasmáticos de colchicina e incrementar su toxicidad.
En los últimos meses se han publicado estudios para evaluar la eficacia de la colchicina en pacientes infectados por SARS-CoV-2.
En el estudio de Scarsi et al8 se concluye que la tasa de supervivencia de pacientes hospitalizados con neumonía y síndrome de distrés respiratorio agudo tratados con colchicina fue significativamente mayor en comparación con la de las personas que recibieron el tratamiento estándar (84,2% versus 63,6%).
Sandhu T et al9 evaluaron el impacto de la colchicina añadida a la terapia estándar en las personas hospitalizadas con COVID-19 moderado-grave, mejorando los resultados en mortalidad e intubaciones frente a la terapia estándar. Asimismo disminuyeron los niveles de PCR, ferritina y dímero D.
En el estudio GRECCO-19 se está estudiando el efecto de la colchicina sobre las complicaciones asociadas a la infección por COVID-19. Se mide la evolución de marcadores cardíacos e inflamatorios (troponina T y PCR) y el desarrollo de neumonía (con necesidad de ventilación mecánica), necrosis del miocardio y tiempo de deterioro clínico. No observan diferencias en los marcadores, aunque sí retrasa el tiempo hasta el deterioro clínico10,11.
A principios de año suscitó gran interés la prepublicación de los resultados del ensayo Colcorona12. Se encontraba una reducción de un 25% en el riesgo de hospitalización, de un 50% en la necesidad de ventilación mecánica y de un 44% de casos de muerte. Este ensayo se detuvo con el 75% de población inicial estudiada y en el análisis por intención de tratar la colchicina no mostró el beneficio esperado. En Murcia13 se está desarrollando el ensayo Colcovid (Clinicaltriasl.gov Identifier: NCT04350320), cuyo objetivo principal es el cambio del estado clínico de los pacientes en la escala ordinal de 7 puntos (OMS R&D Blueprint expert Group) a los 7, 14 y 28 días y el cambio en las concentraciones de IL-6 a los 28 días. Este estudio únicamente ofreció resultados positivos en los predictores de empeoramiento clínico (1 punto) de la Organización Mundial de la Salud. En el momento actual no han sido publicados los resultados de Colcovid.
En nuestra área de salud, a finales de 2020 se modificó el protocolo de tratamiento del SARS-CoV-2 en los hospitales y en urgencias y se estableció el tratamiento con colchicina en pacientes con diagnóstico leve-moderado confirmado, a dosis de 0,5 mg/12 horas durante un período de 15 a 30 días. El objetivo de este estudio es describir la evolución y seguridad de la utilización de colchicina basada en el anterior protocolo en los pacientes no ingresados tratados en la GAI de Albacete y que presentan un diagnóstico de enfermedad por coronavirus SARS-CoV-2.
MÉTODOS
Se trata de un estudio observacional con medicamentos (EOm) retrospectivo.
La población estudiada se componía de pacientes no ingresados de la GAI de Albacete mayores de 18 años con diagnóstico compatible con SARS-CoV-2: CIE: V01.82, V079.82, V480.3 y CIAP: A77.01, y que han recibido tratamiento con colchicina durante el período comprendido entre noviembre de 2020 y febrero de 2021. Se han excluido aquellos pacientes con diagnóstico compatible con SARS-CoV-2 que toman colchicina para alguna de las indicaciones autorizadas en su ficha técnica, o bien para otras indicaciones no autorizadas, pero ampliamente utilizadas, como la pericarditis.
Los pacientes se han seleccionado empleando los sistemas informáticos de Atención Primaria y los programas de facturación de receta de nuestro Servicio de Salud. Cruzando ambas bases, la muestra inicial es de 389 pacientes, que, entre el 1 de noviembre de 2020 y el 28 de febrero de 2021, habían retirado de la oficina de farmacia uno o dos envases de colchicina y presentaban un diagnóstico de COVID-19.
La muestra final es de 315 pacientes, una vez excluidas las personas que no cumplen algunos de los criterios de inclusión (ser mayor de 18 años, presentar diagnóstico compatible con la COVID-19 y retirar en el período de estudio un envase mínimo de colchicina).
Las variables principales del estudio son:
- Porcentaje de pacientes que requieren atención hospitalaria después de la toma de colchicina, entendiendo por atención hospitalaria tanto ingreso como nueva visita a urgencias del hospital.
- Porcentaje de pacientes fallecidos por COVID-19.
- Porcentaje de pacientes que presentan durante el tratamiento un evento adverso relacionado con la toma del fármaco.
Otras variables recogidas han sido la edad, sexo, paciente en domicilio o institucionalizado, positividad a PCR y/o test de antígenos, presencia o no de neumonía confirmada radiológicamente, confirmación de clínica COVID-19 leve-moderada o grave y cálculo del valor de Call-score. Se ha definido como COVID-19 con clínica leve-moderada la presencia de una sintomatología constitucional (tos, cansancio y fiebre, diarrea, cefalea, alteraciones del gusto y olfato) que podía evolucionar a grave con la aparición de disnea e hipoxemia (presión arterial de oxígeno/fracción inspirada de oxígeno PaO2/FiO2 ≤ 300 mmHg) e infiltrados pulmonares (bilaterales) con elevación de marcadores inflamatorios y de disfunción endotelial o coagulación (ferritina, proteína C reactiva, dímero D)14. Como factores de riesgo se han registrado los diagnósticos compatibles con: enfermedad pulmonar obstructiva crónica (EPOC), cáncer, diabetes, hipertensión arterial (HTA), enfermedad cardiovascular (ECV), inmunosupresión o hepatopatía crónica. Como parámetros analíticos se han recogido: aclaramiento de creatinina, proteína C reactiva, ferritina y dímero D.
Dentro de las variables relacionadas con el fármaco: tratamiento previo con colchicina, dosis y pauta de colchicina prescrita y la aparición de reacciones adversas (RAM): gastrointestinal, sobredosificación, hepática, cutánea, renal o sistema nervioso. Como tratamientos usados junto a la colchicina para tratar la COVID-19 se ha registrado la utilización o no de HBPM, corticosteroides, acetilcisteína, vitamina D y antibióticos. Por último, se ha recogido la presencia o no de fármacos con posible interacción con colchicina: macrólidos, antineoplásicos, antivirales, antagonistas del calcio, estatinas, ciclosporina y/o ketoconazol.
Con los datos obtenidos se ha realizado un análisis descriptivo, estadístico bivariante e inferencial de las variables categóricas y cuantitativas, previa comprobación de la normalidad de las variables cuantitativas. Con las variables categóricas se han estimado proporciones, y para las variables continuas, las medias con sus intervalos de confianza. Se ha hecho un contraste de proporciones para muestras independientes (chi-cuadrado) y un contraste de medias para muestras independientes paramétricas (t-Student) y no paramétricas (U de Mann-Whitney).
Los datos han sido introducidos de forma anonimizada y almacenados y analizados mediante el programa SPSS 22.0.
El estudio ha sido aprobado por el Comité de Ética de la Investigación con Medicamentos de la GAI de Albacete, con el código 2021-42. Este estudio se ha hecho cumpliendo con los principios que emanan de la Declaración de Helsinki (Revisión de Fortaleza, 2013), las normas de buenas prácticas clínicas y con la normativa legal vigente. La información es obtenida de manera anonimizada, cumpliendo con la Ley Orgánica 3/2018, de Protección de Datos de Carácter Personal con su última actualización del 25 de julio de 2019.
RESULTADOS
La muestra inicial era de 389 pacientes. De esta se excluyeron 74 pacientes, un 37,8% por pericarditis, un 44,5% por gota, un 1,3% por fiebre mediterránea familiar y un 16,2% por otras causas, quedando una muestra final de 315 pacientes. En la muestra final, el porcentaje de mujeres (51,1%) y de hombres (48,9%) fue similar. La edad media de la muestra fue de 60,9 años (58,98-62,97), siendo la edad media de las mujeres de 61,57 (desviación estándar [DE]: 19,1) y la de los hombres de 60,36 (DE 16,8). La mayoría de los pacientes vivían en su domicilio, y solo un 11,5% eran pacientes institucionalizados.
El 96,8% de los pacientes no estaba en tratamiento previo con colchicina, y la dosis de 0,5 mg/12 horas fue la más utilizada (87,3% pacientes). La mayor parte de la prescripción de colchicina (61,9%) se hizo desde el ámbito de la atención hospitalaria, mayoritariamente en el servicio de urgencias y en el caso de la pequeña muestra de pacientes institucionalizados, desde el servicio de geriatría.
En la tabla 1 se muestran las características clínicas encontradas en pacientes de la muestra: un 74,8% presentaron clínica leve-moderada, el 71,1% de los pacientes fueron diagnosticados con PCR positiva y a un 62,5% de los pacientes se les hizo una radiografía, presentando un 15,8% una neumonía bilateral grave.
Un total de 49 pacientes (15,5%) sufrió un ingreso después del tratamiento con colchicina y de ellos 6 fallecieron por causa de la COVID-19. La media de edad de los pacientes que ingresaron fue de 71,59 (67,35-75,8), con una clínica grave en el 81,6% de los casos y con un porcentaje mayor de mujeres (53,1%). Los parámetros clínicos presentados fueron: ferritina: 839,11 (537-1.141,1); dímero D: 1.436,1 (359,4-2.512,8); proteína C reactiva: 79,72 (51,04-108,39). Un 36,2% de los pacientes tratados volvieron a urgencias después de tomar el fármaco, siendo la media de edad de 61,06 (57,27-64,85).
Al transformar la variable ingreso en dicotómica, sumando los casos de pacientes que volvieron a urgencias o ingresaron, la edad media presentaba una relación estadísticamente significativa con variable nueva de recaída (ingreso + urgencias) de los pacientes (63,25 versus 58,54) (p < 0,05).
Del total de la muestra, solo 182 pacientes (57,7%) tenían una medición de aclaramiento de creatinina. De estos, 170 pacientes presentaron valores de aclaramiento superiores a 50 mL/min/S, 9 con valores entre 30 y 50 mL/min/S y 3 por debajo de 30 mL/min/S. En todos los pacientes con valores de aclaramiento por debajo de 50 se ha utilizado la dosis de 0,5 mg/12 horas. La duración media de los tratamientos con colchicina fue de 11,8 días (DE: 4,51). Se han observado algunas reacciones adversas, siendo la gastrointestinal (3,2%) la principal y se detectaron dos casos de sobredosificación. El factor de riesgo más frecuente encontrado fue la hipertensión, estando presente en más de un 40% de los pacientes.
Se ha encontrado relación estadísticamente significativa (p < 0,05) entre presentar enfermedad grave y la edad media (68,5 versus 58,9). La edad también ha sido un factor importante a la hora de recibir tratamiento con HBPM (66,8 versus 57,8), corticosteroides (64,2 versus 58,5) y presentar neumonía radiológicamente grave (69,3 versus 61,2) (p < 0,05).
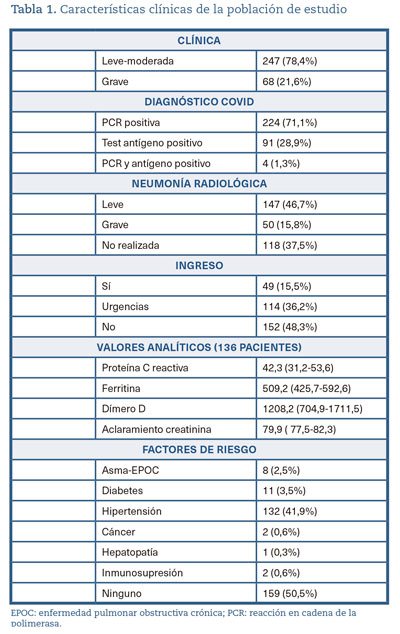
En 136 pacientes se han observado valores de parámetros analíticos relacionados con la COVID-19, como son proteína C reactiva, dímero D y ferritina, destacando la elevada dispersión de los datos especialmente en ferritina y dímero-D (tabla 1).
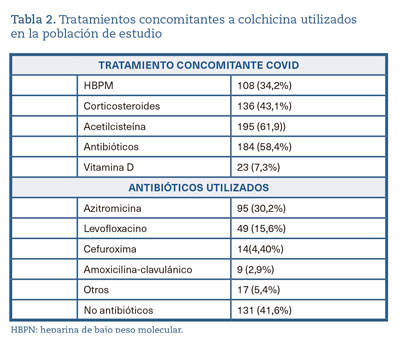
De los tratamientos que han recibido los pacientes junto a la colchicina (tabla 2), sin tener en cuenta los tratamientos de uso hospitalario, destaca la utilización de acetilcisteína, HBPM y corticosteroides y el uso de vitamina D en un 7,3% de los pacientes. En un 58,4% de los pacientes se han utilizado antibióticos, y de estos, a un 52% se les prescribió azitromicina; a un 27%, levofloxacino, y a un 14%, cefalosporinas. La toma de antibióticos y el ingreso hospitalario ha mostrado una relación estadísticamente significativa (p < 0,05), hecho que se ha repetido con la utilización de HBPM y los corticosteroides. Un 56,2% de los pacientes no tomaban medicación que potencialmente pudiera interaccionar con la colchicina; por el contrario, al 32,7% de los pacientes se les ha administrado de manera conjunta colchicina y azitromicina, y en muy baja proporción, estatinas y antagonistas del calcio.
DISCUSIÓN
Hoy son muchos los fármacos que se han quedado por el camino en el tratamiento de la COVID-19. Únicamente los corticosteroides en un momento muy específico de la enfermedad han demostrado utilidad en el tratamiento de los pacientes graves con oxígeno suplementario y/o ventilación mecánica2,15,16. Tocilizumab, remdesivir y baritinib han demostrado eficacia limitada en grupos de pacientes muy seleccionados2,17,18.
A finales del año pasado emergió la colchicina como nuevo tratamiento esperanzador en el tratamiento de la COVID-19, con gran repercusión tanto en medios científicos como generalistas. Estas expectativas ya han sido truncadas, ya que ensayos como el Colcorona12 recientemente publicado19 no ha ofrecido resultados definitivos sobre la eficacia de la colchicina en estos pacientes.
En nuestra GAI se actualizó el protocolo de manejo y tratamiento de enfermos de COVID-19 y en él se incluyó la colchicina para tratar a pacientes con diagnóstico leve-moderado, hecho que supuso un incremento en la prescripción de este fármaco y que nos suscitó la curiosidad por describir sus bondades, si es que las tenía.
Aunque es un tratamiento ampliamente aceptado, hay que destacar que el amplio uso de colchicina en pericarditis y otra patología cardíaca se encuentra fuera de las indicaciones de uso recogidas en la ficha técnica, por lo que se deberían extremar las precauciones al usar este fármaco debido a su condición de estrecho margen terapéutico. Casi un 38% de los pacientes excluidos del estudio, presentaban una pericarditis. Aunque no es el objetivo de este estudio, es importantísimo recalcar que en nuestra población aproximadamente el 20% de estas pericarditis se han producido después de haber padecido la enfermedad por la COVID-19 y se hace más necesario que nunca investigar este hecho por las importantes repercusiones clínicas que pudiera tener.
La principal conclusión que podemos sacar de nuestros resultados es que la utilización de colchicina no ha modificado el curso de la enfermedad ni los ingresos hospitalarios. En nuestra muestra, la mortalidad ha sido de un 1,9% de los pacientes y un 15,5% de los mismos ha requerido ingreso hospitalario.
La edad se ha mostrado como un factor importante de riesgo para el ingreso hospitalario y a su vez los pacientes con más edad han recibido más tratamientos con HBPM y corticosteroides. Al contrario que en otros estudios9, en nuestra muestra no se ha observado variaciones significativas de los parámetros analíticos. Los pacientes que han recibido antibióticos han mostrado un nivel de ingresos superior al resto de pacientes.
Por ser un medicamento de estrecho margen terapéutico, para instaurar la dosis de colchicina es necesario tener en cuenta la función renal. A la vista de nuestros resultados, podemos afirmar que este parámetro analítico no se tiene suficientemente en cuenta, ya que poco más de la mitad de los pacientes tienen valores de aclaramiento de creatinina previos al uso de colchicina y, además, entre los pacientes con valores disminuidos del mismo no se ha tenido en cuenta a la hora de reducir la dosis o directamente no utilizar la colchicina20. Otro hecho relacionado con la toxicidad de la colchicina son las interacciones medicamentosas, y podemos ver que no se ha tenido en cuenta el uso concomitante con azitromicina, lo cual puede provocar un aumento de las concentraciones de colchicina e incrementar su toxicidad20.
Se ha encontrado un elevado número de pacientes a los que se les ha prescrito corticosteroides, estando actualmente cuestionado su uso en pacientes extrahospitalarios, ya que su utilización temprana en personas con enfermedad leve-moderada puede empeorar el pronóstico15,16,21.
El uso de vitamina D22,23 ha demostrado eficacia nula o muy escasa en la prevención y tratamiento de la infección por COVID-19, y aunque el uso en este grupo de pacientes ha sido escasamente de un 7%, es de destacar que en todos los casos en que se ha prescrito ha ido acompañada de HBPM, corticosteroides, acetilcisteína y antibióticos. En los datos de los pacientes de enero y febrero se ha observado una desviación de la prescripción de HBPM hacia ácido acetilsalicílico 100 mg, aunque no disponemos de los datos exactos.
En la primera parte de la pandemia se utilizó masivamente azitromicina, debido fundamentalmente a dos factores: ausencia de tratamientos efectivos frente al coronavirus y su supuesto efecto beneficioso por su mecanismo de acción. A la vista de los numerosos estudios21,24,25 que han demostrado la ineficacia de la azitromicina en esta enfermedad, resulta chocante que casi un 60% de los pacientes de este estudio tengan prescrito un antibiótico y que en la mitad de los casos dicho antibiótico sea azitromicina. También se refleja en nuestro estudio un cambio en la prescripción de antibióticos, ya que se ha pasado de prescribir mayoritariamente azitromicina en la primera parte de la pandemia a recetar levofloxacino y cefalosporinas en numerosos casos.
Nuestro estudio presenta limitaciones —las inherentes a nuestro diseño observacional y transversal—, de manera que puede haber diferencias en la interpretación y recogida de algunas variables por los diferentes investigadores, sobre todo en las variables clínicas que presentaba el paciente, que, aunque están definidas, se presta a interpretación. Y con respecto al sesgo de selección, este se puede haber minimizado al incluir a todos los pacientes tratados con colchicina en el período de estudio.
Mientras que en el ámbito hospitalario se ha autorizado el uso de ciertos medicamentos (por ejemplo: baricitinib) en pacientes graves y muy graves, en Atención Primaria y a la vista de los resultados publicados hasta el momento no existen datos definitivos que avalen el uso de colchicina y otros fármacos en el manejo de los pacientes ambulatorios con clínica leve-moderada.



