Introducción
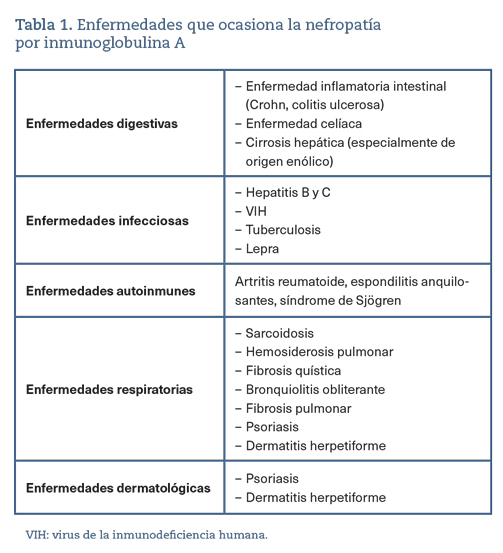
La nefropatía inmunoglobulina A (NIgA) es la glomerulonefritis primaria más frecuente, que requiere derivación a consulta de nefrología1. Se manifiesta en la práctica clínica como hematuria recurrente, con o sin proteinuria2. La incidencia global es de al menos 2,5 por 100.0003. La NIgA además puede asociarse a diversas enfermedades3 (tabla 1).
Etiopatogenia: la NIgA está condicionada porque la IgA presenta un déficit en galactosa (IgA gal def o IgA 1). Se produce proliferación de células mesangiales, estrés oxidativo e intervención de factores del complemento, y daños en células tubulares. Se incrementa la permeabilidad en glomérulos y aparece esclerosis glomerular. Se asocia a la aparición de proteinuria y hematuria, y el desarrollo de hipertensión arterial.
La biopsia renal es necesaria para diagnosticar la enfermedad e identificar y tipificar la posible recurrencia de la NIgA en el injerto renal de pacientes trasplantados, sobre todo si se asocia hematuria y/o proteinuria mayor de 0,5-1 g/día, o progresión a enfermedad renal crónica.
Las cifras de IgA en suero pueden permanecer altas de forma continuada, pero no es un dato específico ni diagnóstico de NIgA. Los valores de complemento (C3, C4) suelen ser normales.
Dentro del diagnóstico diferencial, han de considerarse aquellas entidades que cursan con microhematuria y proteinuria: vasculitis de pequeño vaso o nefritis lúpica (aunque suelen asociar clínica sistémica), síndrome de Alport (sospechar especialmente en pacientes con antecedentes familiares) o glomerulonefritis postinfecciosa (si bien se relaciona principalmente a infecciones estreptocócicas, y la NIgA puede aparecer tras cualquier infección, especialmente de tipo vírica).
La proteinuria en torno a 0,5 g/día se asocia a mejor evolución, sin embargo, las cifras por encima de 1 g/día conllevan un incremento de riesgo de casi 50 veces para progresión de enfermedad renal crónica.
La necesidad de trasplante renal ronda el 10% a los 5 años del diagnóstico y el 40% a los 20 años.
Caso clínico
Nuestro caso clínico trata sobre una mujer de 60 años, que en el año 2000 fue diagnosticada de hipertensión arterial maligna y nefroangioesclerosis. Fumadora, sin alergias conocidas.
Desarrolló enfermedad renal crónica e inició hemodiálisis en 2007. Se le diagnosticó osteoporosis en columna lumbar, probablemente en contexto de hiperparatiroidismo secundario a la enfermedad renal. Fue intervenida en 2008 con trasplante de donante en muerte encefálica y se pautó tratamiento con prednisona, tacrolimus y micofenolato.
En 2008 se le hizo una biopsia por leve deterioro de la función renal, con diagnóstico de rechazo agudo borderline, y tras tratamiento con metilprednisolona a dosis elevadas, su creatinina quedó en valores de 1,2 mg/d.
En 2012 se le hizo una nueva biopsia renal por elevación de creatinina a 1,6 mg/dL, y se detectó nefrotoxicidad por tacrolimus. Al alta de este proceso se disminuyó la dosis de tacrolimus y se asoció everolimus, con mejoría de la creatinina hasta 1 mg/dL.
En 2017 se suspende la administración de bifosfonato oral y se pauta denosumab 60 mg inyectable semestral, y paricalcitol cada 72 horas.
En 2018, con mal control de la hipertensión arterial, se modifican dosis de enalapril, porque además se observa aumento de proteinuria hasta 0,65 g/día, en probable relación con everolimus. La creatinina se eleva a 2,6 mg/dL, por lo que se hizo estudio en nefrología con resultados: anticuerpos anti-HLA negativos, virus hepatotropos negativos, eco-Doppler renal normal.
Desde el trasplante renal, el seguimiento llevado a cabo en nuestra consulta y en nefrología ha mostrado estabilidad de la función renal de la paciente, con una creatinina basal en torno a 2,5 mg/dL, microhematuria y proteinuria. Desde la última biopsia, los resultados de control analítico han permanecido estables, la medicación que tomaba era: prednisona 2,5 mg cada 2 días, everolimus 1,25 mg cada 12 horas, tacrolimus 4 mg diarios, omeprazol 20 mg diario, ezetimiba/atorvastatina 10/20 mg en cena, denosumab 60 mg cada 6 meses, cinacalcet 60 mg diaria, vitamina D 25.000 UI una ampolla mensual, lorazepam 1 mg diaria, manidipino 10 mg diaria y losartán 100 mg diaria.
En la bibliografía revisada, se ha constatado que la presentación clínica habitual de la NIgA en la población infantil es con hematuria macroscópica tras la aparición de una infección respiratoria o digestiva. En la población adulta, es más frecuente en hombres que en mujeres (proporción 2,5:1).
Si se asocian cuadros clínicos de púrpura cutánea o clínica digestiva, hay que descartar como causa una vasculitis IgA (antes denominada púrpura de Schönlein-Henoch). En la exploración se asocia a una púrpura palpable, y en la anatomía patológica se objetiva vasculitis leucocitocástica en los capilares de la dermis4,5.
El 20-40% de pacientes con NIgA desarrollan deterioro de su función renal entre 10 y 20 años después del diagnóstico3. Es raro que se presente como fracaso renal agudo oligoanúrico, salvo que se produzca una hematuria macroscópica que condicione una nefropatía por cilindros hemáticos.
Durante la pandemia de la COVID-19, se han detectado pacientes con nefropatía IgA o púrpura de Schönlein-Henoch4. Hay descritos casos que desarrollaron hematuria macroscópica después de la administración de vacuna frente a SARS-CoV-26.
La IgA presenta un déficit en galactosa (IgA gal def o IgA 1). Aumenta la fracción de la IgA 1, generada en células plasmáticas. Hay asociación de patrón autosómico dominante que predispone a la generación de IgA 1.
Se forman inmunocomplejos IgA 1 tras la exposición de grupos de N-acetilgalactosamina en la región bisagra de la IgA 1. Cuando estos epítopos son detectados por anticuerpos anti-IgG o anti-IgA 1, hay formación de complejos inmunes (no está claro si se depositan directamente al pasar por el mesangio o se forman en la sangre antes de filtrarse en el riñón). Existe depósito mesangial de IgA, en especial la subclase polimérica IgA 1.
Hay correlación entre la formación de anticuerpos antiglicanos que reaccionan de forma cruzada con la IgA1 cuando coexisten algunas infecciones bacterianas o víricas que tienen en la membrana celular N-acetilgalactosamina.
Después hay proliferación de células del mesangio renal que puede ocasionar lesiones celulares por el incremento de expresión de óxido nítrico sintetasa, liberación de angiotensina II, aldosterona y citoquinas proinflamatorias, factores de crecimiento y posterior fibrosis.
El desarrollo de proteinuria y de hipertensión arterial está condicionado por la excesiva proliferación de células mesangiales, estrés oxidativo, intervención de factores del complemento y daños en células tubulares. El depósito de C4d es un factor de mal pronóstico a largo plazo.
Aumenta la permeabilidad glomerular y se produce esclerosis de glomérulos. Como consecuencia de todo ello, se desarrollan proteinuria y hematuria asociadas junto a la hipertensión arterial. Los niveles de ácido úrico pueden influir en el proceso.
El 5% de pacientes tienen algún familiar con NIgA confirmada. Hay una asociación de locus de susceptibilidad en el DQ, en el cromosoma 6p21, en el 1q32, en el conjunto de genes que codifican el factor H del complemento y en el 22q12.41.
El tratamiento farmacológico debe ir dirigido a reducir la proteinuria, controlar la hipertensión arterial y adecuar los corticoides e inmunosupresores para evitar la rápida progresión de la enfermedad con lesiones activas en la biopsia renal7.
Se sospecha NIgA por pruebas de laboratorio, pero se requiere la biopsia renal como gold standard de diagnóstico. Existe una clasificación pronóstica (de Oxford) que se basa en los criterios histológicos. Los de peor pronóstico son:
- Hipercelularidad mesangial (M1), glomeruloesclerosis segmentaria (S1).
- Grado de atrofia tubular y fibrosis intersticial (T1-2).
- El depósito de C4d mesangial.
- Se puede asociar microangiopatía trombótica y/o presencia de semilunas (C1, C2).
Hay casos descritos de pacientes con uveítis unilateral recurrente, de características granulomatosas con inflamación vítrea, asociada a proteinuria de rango no nefrótico y microhematuria, donde la biopsia renal confirmó NIgA8.
Tratamiento farmacológico de la enfermedad9:
- Los inhibidores de enzima de conversión de angiotensina (IECA) y los antagonistas del receptor de angiotensina II (ARA II) contribuyen a disminuir la proteinuria y evitar el deterioro de filtrado glomerular (sobre todo en proteinurias superiores a 0,5 g/día).
- No está clara la asociación de ambos fármacos en la evolución de la enfermedad, pero sí se pueden combinar con antagonistas de receptores de mineralcorticoides y antagonistas del calcio, siempre que exista proteinuria crónica persistente.
- Se recomienda atenerse a las guías clínicas en el control de cifras de colesterol total y colesterol de lipoproteínas de baja densidad (cLDL), y resto de factores de riesgo cardiovascular.
- La elección de uso de corticoides y del tipo de inmunosupresor que hay que utilizar queda en manos de los nefrólogos.
Según una revisión de Cochrane Library de 2020, la terapia con esteroides puede evitar la progresión de insuficiencia renal en la NIgA, ya que reduce la inflamación glomerular.
Respecto al tipo de inmunosupresores que se ha de utilizar:
- Los inhibidores de la calcineurina ofrecen datos limitados para la protección de la función renal en esta patología.
- Aunque existe controversia, el ácido micofenólico podría ser beneficioso en aquellas nefropatías IgA progresivas con un perfil de seguridad aceptable.
- Los efectos de otros regímenes inmunosupresores (incluidos esteroides más inhibidores de mTOR) no fueron concluyentes10.
Discusión
En noviembre de 2022 se exploró en consulta de Atención Primaria a la paciente: auscultación rítmica sin soplos, buen murmullo vesicular en auscultación pulmonar, y el abdomen era blando sin dolor y peristaltismo normal. No presentaba edemas.
En revisión de nefrología, el resultado de la creatinina basal fue de 2,9 mg/dL, persistiendo albuminuria de 1.400 mg/g y microhematuria, sin síntomas clínicos asociados, por lo que se decide nueva biopsia del injerto. En esta se detectan signos de nefrotoxicidad por tacrolimus y esclerosis glomerular del 28%, sin datos de rechazo, objetivándose una afectación glomerular con expansión y proliferación mesangial compatible con nefropatía IgA (inmunofluorescencia positiva).
En el ingreso, asoció anemia con hemoglobina 10,9 g/dL y la creatinina era de 3,07 mg/dL, con filtrado de 16 mL/min/1,73 m2.
Al alta hospitalaria, la paciente remonta: con hemoglobina de 12,5 g/dL y la creatinina se mantiene en 3 mg/dL, sin alteraciones iónicas. A las 2 semanas se repitió nuevo control analítico y se citó a la paciente en consulta de nefrología para dar resultados: creatinina 2,8 mg/dL y proteinuria de 1,2 g/día. Finalmente, se pauta tratamiento inmunosupresor con tacrolimus 4 mg diarios, prednisona 2,5 mg cada 2 días y denosumab 60 mg cada 6 meses.
Por la biopsia renal del injerto, pensamos que la NIgA pudo ser la etiología de su enfermedad renal. Dado que no hay constancia de biopsia en sus riñones nativos, no tenemos un diagnóstico de certeza, aunque la hipertensión maligna (con la que debutó la paciente) se asocia a NIgA.
En relación con el desarrollo de la NIgA en la paciente, tras años de evolución del trasplante renal, se detecta un empeoramiento de su función renal, asociándose hematuria y proteinuria.
En la biopsia hecha en 2022 se detectó que padecía una NIgA, por lo que se adecuó el tratamiento farmacológico (inmunosupresión y control de factores de riesgo cardiovascular). Actualmente se continúa realizando seguimiento clínico para preservar su función renal. Se destacan los aspectos relevantes de la NIgA (tabla 2).
Conclusiones
- Sospecharemos NIgA cuando se detecte hematuria, con o sin proteinuria, asociada a deterioro de la función renal. Menos frecuente es la presentación como síndrome nefrótico, que ocurre sobre todo en población mayor.
- La NIgA es una patología poco habitual que hay que detectar a tiempo para evitar que su evolución conduzca a un deterioro de la función renal.
- El tratamiento farmacológico de la NIgA desde Atención Primaria tiene como objetivos: disminuir la proteinuria, regular las cifras de tensión arterial, y optimizar la terapia de inmunosupresión y corticoides orales.
- Los fármacos de elección para la hipertensión y la proteinuria son: IECA y ARA II. Se pueden asociar antagonistas del calcio y antagonistas de receptores de mineralcorticoides.
- Desde Atención Primaria debemos hacer un seguimiento exhaustivo de los factores de riesgo cardiovascular de pacientes con NIgA.
Agradecimientos
La paciente fue informada sobre la publicación de este artículo y dio su consentimiento. No constan datos que la identifiquen.