Los glucocorticoides (GC) son fármacos frecuentemente usados de forma crónica para el tratamiento de enfermedades autoinmunes, hematológicas y neoplasias avanzadas. La prevalencia de población en tratamiento crónico con GC se estimó en un 0,9% en el Reino Unido1. Además de sus efectos beneficiosos antinflamatorios, los GC se pueden asociar a la aparición de insuficiencia suprarrenal (IS)2. La prevalencia de IS secundaria a GC se ha estimado en hasta un tercio de los pacientes en tratamiento crónico con GC con artritis reumatoide y hasta en casi la mitad de los pacientes trasplantados renales3-4.
Observaciones clínicas
Presentamos el caso de una paciente de 65 años, fumadora activa, diagnosticada de sarcoidosis pulmonar en 2012. La paciente presentaba al inicio de su enfermedad adenopatías hiliares pulmonares bilaterales, paratraqueales y subcarinales, con astenia intensa y elevación de enzima convertidora de angiotensina (ECA), con niveles de 108 UI/L (normal: 8-52 UI/L). Se inició tratamiento corticoideo con dosis de prednisona 30 mg diarios. Tras 3 años de tratamiento, la prednisona se pudo ir reduciendo de forma gradual hasta niveles de 2,5 mg/día. Antes de interrumpir el tratamiento prolongado con GC, se determinó el cortisol basal para descartar IS asociada. El cortisol basal fue de 15,5 µg/dL, con niveles de hormona adrenocorticotrópica de 17,6 pg/mL, por lo que se constató normalidad del eje hipofisario-suprarrenal. El tratamiento con GC se interrumpe en 2015. En octubre de 2017, la paciente acude de nuevo a la consulta de medicina interna por presentar astenia intensa, así como pérdida de fuerza y anhedonia. La paciente presenta reactivación de su patología, con niveles de ECA de 128 UI/L, con incremento de adenopatías mediastínicas en la tomografía axial computarizada (TAC) de control. Se inicia de nuevo prednisona a dosis de 20 mg diarios. Dada la presencia de eventos adversos asociados al tratamiento corticoide (aumento de peso gradual y presencia de glucemia basal alterada), se decide iniciar metotrexate 7,5 mg oral. De este modo, se reduce paulatinamente la dosis de prednisona a 10 mg diario y, posteriormente, a 2,5 mg en el transcurso de 6 meses, suspendiéndose finalmente en mayo de 2018. En diciembre de 2018 se retira el tratamiento con metotrexate al estar la enfermedad controlada con niveles de ECA de 32 UI/L. La paciente es seguida en la consulta y 6 meses más tarde, en junio de 2019, acude de nuevo presentando clínica inespecífica, con astenia intensa y sudoración profusa. En el análisis de control, los niveles de ECA son de 54 UI/L, con velocidad de sedimentación globular (VSG) 9. Ante la no reactivación de su sarcoidosis, se solicita cortisol basal y ACTH, con niveles de 0,8 µg/dL y 5 pg/mL, respectivamente. Ante la presencia de insuficiencia suprarrenal secundaria a tratamiento prolongado con GC(último período de tratamiento desde octubre de 2017 a mayo de 2018), se inicia tratamiento con hidrocortisona 20 mg/día, distribuyéndose 10 mg en desayuno, 5 mg en comida y 5 mg en merienda. Se solicita perfil hipofisario y se descartan otras alteraciones hipofisarias (hormona luteinizante: 13,1 UI/L [7,7-59]; hormona foliculoestimulante: 37,9 UI/L [25,8-134,8]; hormona estimulante de la tiroides: 1,58 mUI/L [0,4-3,77]).
Discusión
El problema clínico fundamental que se plantea en el paciente en tratamiento crónico con GC es el riesgo de aparición de IS tras la retirada del tratamiento. Sin embargo, la IS puede estar presente incluso en el paciente que se encuentra con una mínima dosis eficaz de GC3-4. Entre los factores que pueden determinar el riesgo de aparición de IS secundaria a GC, están la dosis total acumulada y la duración del tratamiento5. En una revisión sistemática, el uso de GC durante un mes se asoció a una prevalencia de IS de 1,4%, siendo de hasta el 27,4% en tratamientos de duración superior a 1 año. El tratamiento con GC a dosis medias y a largo plazo (durante más de 1 año) se asocia con la presencia de IS hasta en el 56,4% de los casos5. Sin embargo, no hay ningún límite ni en dosis acumulada ni en tiempo de tratamiento que sean predictores de la aparición de IS5.

La tabla 1 muestra el riesgo de los pacientes de presentar IS según la dosis y la duración del tratamiento6.
Muchos de los pacientes que presentan IS tienen clínica inespecífica. La aparición de síntomas típicos de IS como hiponatremia, hipotensión, hipoglucemia y debilidad generalizada son muy inespecíficos y no ayudan a identificar al paciente con IS, lo que se traduce en múltiples consultas a Atención Primaria7. La determinación de cortisol basal, entre las 8:00-9:00 h de la mañana sigue siendo el test de detección habitual de la IS6. Un cortisol basal < 3,6 µg/dL confirma la presencia de IS y no implica la realización de test adicionales6. Un cortisol < 5 µg/dL también es muy sugerente de IS. Si el cortisol es >15 µg/dL, se descarta la presencia de IS en la mayoría de los casos, aunque un cortisol >18 es más específico y descarta con total probabilidad la IS6. Un valor de 10-15 µg/dL es muy sugestivo de normalidad del eje hipofisario-adrenal, pero habrá pacientes con estos valores que presentarán IS6. En el paciente en tratamiento con GC se han objetivado valores similares de cortisol diagnósticos de IS7. Un cortisol basal > 13,6 µg/dL tiene una alta especificidad (95%) para determinar suficiencia del eje hipofisario-adrenal. Un valor de cortisol > 8,5 µg/dL ha mostrado alta sensibilidad (84%) con menor especificidad (71%)8. En la figura 1 se presenta un algoritmo de diagnóstico de la IS.
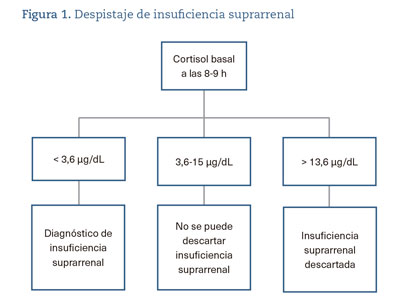
La paciente que hemos presentado estuvo en tratamiento con GC durante un período prolongado de 3 años, habiéndose retirado los GC tras una determinación de cortisol de 15,5 µg/dL. En cambio, en el último ciclo de tratamiento corticoideo durante 8 meses, no se realizó determinación de cortisol, pero sí se hizo una retirada con reducción progresiva de GC conforme las guías clínicas6,9.
El caso clínico expuesto demuestra la importancia del riesgo de IS en el paciente que está en tratamiento crónico con GC. Es labor importante del médico y la médica de Atención Primaria sospechar la presencia de IS en estos pacientes. La determinación de cortisol en ayunas es una herramienta de cribado y diagnóstico sencilla y fácil de abordar desde nuestro nivel asistencial.
Agradecimientos
Se obtuvo el consentimiento escrito de la paciente para la publicación del manuscrito.



