Historia y contexto de las recomendaciones «no hacer»
En 2010, Howard Brody escribió el editorial «Medicine’s Ethical Responsibility for Health Care Reform. The Top Five List»1. Fue toda una declaración de intenciones en la que el autor hace una dura crítica al excesivo número de pruebas diagnósticas y, por ende, de prescripción de tratamientos en el sistema estadounidense. Como solución al problema, hace un llamamiento a que todas las sociedades científicas del país propongan un panel de expertos para elaborar un total de cinco recomendaciones sobre pruebas diagnósticas o tratamientos costosos de cada especialidad que, según la evidencia, no demostraban aportar ningún beneficio significativo. Lo que pretendía era la creación de un listado para que dentro de cada especialidad se pudiera ahorrar la mayor cantidad de dinero sin privar a nadie de beneficio médico. El artículo de Brody fue un guiño a la ley que el entonces presidente estadounidense Barack Obama trataba de impulsar en ese momento, la Patient Protection and Affordable Care Act, conocida como ObamaCare2. De manera casi simultánea, la Sociedad Americana de Medicina Interna (ABIM, por sus siglas en inglés) concede una beca a la National Physicians Alliance (NPA) para que haga un listado de cinco actividades basadas en la evidencia demostrada que se pudieran incorporar en la práctica diaria de las/los especialistas de Medicina de Familia, Medicina Interna y Pediatría. Así, en 2012, la ABIM creó la iniciativa Choosing Wisely3. El objetivo principal era promover el diálogo entre pacientes y profesionales sobre las pruebas diagnósticas, tratamientos y procedimientos necesarios e innecesarios. En el momento actual, son más de 80 sociedades las que colaboran en Choosing Wisely. La iniciativa no tardó en extenderse a otros países, como Canadá, con Choosing Wisely Canada4; el Reino Unido, con Do Not Do, promovido por el National Institute for Health and Care Excellence (NICE)5, y España, con las recomendaciones «no hacer»6.
En nuestro territorio, las recomendaciones «no hacer» se integraron en el Plan Nacional de Calidad del año 2012. El proyecto se inició en 2013 de la mano del Ministerio de Sanidad, Servicios Sociales e Igualdad y con la Sociedad Española de Medicina Interna (SEMI), que fue la primera sociedad que lanzó la propuesta en recomendaciones «no hacer» basadas en la evidencia6. El objetivo principal era disminuir la utilización de intervenciones consideradas innecesarias por no haber demostrado evidencia científica, tener escasa efectividad y no ser costo-efectivas. Los objetivos secundarios de la iniciativa fueron6: 1) evitar la yatrogenia secundaria a la realización de intervenciones innecesarias; 2) disminuir la variabilidad en la práctica clínica; 3) contribuir a difundir entre profesionales de la salud el compromiso con la calidad y la eficiencia de los cuidados, y 4) contribuir a difundir entre la población la utilización adecuada de recursos sanitarios. A partir de aquí, se creó un espacio colaborativo con otras sociedades científicas españolas para que cada una de ellas elaborara cinco recomendaciones siguiendo la línea de Brody1. Hoy, todas estas recomendaciones se pueden consultar en la web del Ministerio de Sanidad y en la Guía Salud7, organismo que se encarga de su evaluación e inclusión. En el momento actual, el portal de Guía Salud7 ha incluido un total de seis recomendaciones relacionadas con la Medicina Familiar y Comunitaria (MFyC).
Al hablar de la iniciativa «no hacer», no se puede dejar de mencionar a la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), que desde los inicios ha colaborado con el Ministerio y desde el año 2013 viene publicando de manera anual uno o dos documentos en cada una de las esferas que aborda la MFyC. En los últimos años, el formato de los documentos ha pasado de ser recomendaciones más generales a propias de cada ámbito. En su repositorio cuenta con un total de 15 publicaciones, las últimas han sido recomendaciones «no hacer» en salud mental, traducida al inglés, y en dolor crónico8.
Las recomendaciones «no hacer» nacieron con el objetivo de ahorrar costes económicos, ayudar a mejorar la práctica clínica, evitar daños innecesarios a las personas mediante pruebas diagnósticas y tratamientos y, en definitiva, mejorar la calidad asistencial. En dicho artículo se pretende hacer una revisión de las prácticas de bajo valor (PBV), la metodología para la elaboración de las recomendaciones y el impacto de su aplicación en la práctica clínica habitual.
Prácticas de bajo valor
Tal y como explican Añel Rodríguez et al., las PBV se definen como intervenciones, ya sea a nivel diagnóstico o a nivel terapéutico, que no han demostrado eficacia, ya sea porque su relación coste/beneficio es desfavorable o porque este no se conoce bien9. Suelen aportar poco o nulo beneficio a la persona (y potencialmente causar daño), además de incurrir en un exceso de costos para la persona y el sistema sanitario10. Es posible citar ejemplos en casi toda la diversidad de los actos sanitarios: tomografías computarizadas (TC) o analíticas repetidas, sobreprescripción de medicamentos, cirugías mayores11 o incluso «medidas preventivas» (como en el caso de determinados cribados de cáncer), que terminan conllevando daños mediante falsos positivos, cascadas diagnósticas, sobrediagnóstico y sobretratamiento. Las PBV no se fundamentan en la evidencia científica actual, hasta el punto de que un metanálisis de intervenciones sanitarias (filtrado por las revisiones Cochrane) revela que más del 90% de ellas carecen de respaldo en evidencia de alta calidad12. Su continua presencia en la atención sanitaria responde muchas veces a la «medicina defensiva» y no tanto a mala praxis, ya que dichas prácticas surgen de protocolos, políticas públicas y guías científicas y de consenso10.
Es importante destacar también que dentro del propio término «prácticas de bajo valor» coexisten diferentes significados y diferentes visiones según desde dónde se emplee. Por un lado, «valor» puede ser una definición de beneficio neto: de los beneficios y costes esperados de una práctica en comparación con las alternativas (incluyendo la ausencia de tratamiento) para un grupo o una persona13. Con esa definición, que aparentemente nos transporta al mundo de la gestión, las acciones deberían ir orientadas a reducir el uso de las PBV con el objetivo de reducir costes y mejorar la eficiencia14. Por otro lado, «valor» también puede referirse a principios humanísticos de los sistemas sanitarios, incluyendo aquí la perspectiva de profesionales en su práctica diaria y de pacientes y de los resultados que consideran realmente significativos y estimables14.
Sin embargo, a pesar de las diferencias de enfoque, en la mayoría de las ocasiones las PBV deben observarse con su conjunto de significados, ya que la práctica clínica, la experiencia a nivel de paciente y la gestión asistencial no han de ser compartimentos estancos. A nivel de cualquier práctica asistencial, sobre todo en el contexto de la MFyC, si se trabaja buscando una atención centrada en la persona (ACP) de calidad, es crucial optimizar las acciones en consulta y deshacerse de las prácticas que añadan tareas y quiten tiempo y espacio a otras necesidades. Desde la perspectiva de la gestión asistencial, la eficiencia no puede pasar solo por reducir los tiempos de consulta, aumentar los cupos o el número de visitas diarias. La eficiencia debe replantear la calidad de las acciones, prácticas y políticas, y si resultan ser de bajo valor, exponer alternativas basadas en la evidencia, no solo apelando al profesionalismo del profesional (que, aunque esencial, no es suficiente)15. De hecho, la evidencia indica que, para modificar el comportamiento de profesionales de la salud, el enfoque de gestión (como la reducción de costos, la mejora del rendimiento, la eficiencia, etc.) es un motivador muy poco efectivo para la mejora de la calidad en la atención16. Es aquí donde las recomendaciones «no hacer» son necesarias en el contexto de las PBV: amalgaman evidencia sobre las PBV, apelan a profesionales, no necesariamente trabajando en gestión, y buscan que se reduzcan centrándose en la clínica y la persona enferma.
Métodos
Transformar un dilema clínico en una pregunta que se pueda responder
Como se ha comentado en las líneas previas, el objetivo de una recomendación «no hacer» es proporcionar recomendaciones clínicas orientadas a identificar y evitar intervenciones de bajo valor o potencialmente perjudiciales17. Con ello se pretende evaluar y reflexionar sobre prácticas vigentes a través de esta perspectiva, con el fin de identificar limitaciones en el ejercicio clínico habitual. Este valor bajo o perjudicial se determina cuando una práctica no demuestra beneficios comprobados, aumenta el riesgo de daño o contribuye al uso ineficiente de recursos sanitarios y/o sociales. Para ello, es imprescindible una visión crítica con el estado del conocimiento.
La identificación de una necesidad de conocimiento surge de una situación clínica específica, lo que da lugar a la formulación de una pregunta clínica. Estos dilemas clínicos o preguntas de investigación se caracterizan por tener un carácter específico y focalizado en elementos particulares de un caso clínico y perseguir el propósito de proporcionar una base científica sólida para la toma de decisiones clínicas inmediatas. Es decir, su objetivo es responder a interrogantes concretos que surgen en la atención médica cotidiana, aportando un enfoque útil para el manejo individualizado de quienes se atiende y basado en la evidencia. Para ello, las cuestiones deben estar orientadas a situaciones reales, requieren análisis profundos y deben brindar respuestas fundamentadas, proporcionando datos clave para orientar la elección de tratamientos o valorar distintas alternativas terapéuticas en escenarios clínicos particulares. Pueden involucrar diversos temas, desde la selección de una intervención hasta la evaluación de una prueba diagnóstica o el riesgo de la exposición a un determinado factor. Su ámbito de aplicación es amplio, ya que abarcan todas las decisiones que cada profesional sanitario debe tomar en el día a día para ofrecer la mejor atención a sus pacientes.
La formulación de un dilema clínico se fundamenta en las siguientes premisas:
- Responde a problemas cotidianos de la práctica clínica. Una pregunta de investigación clínicamente relevante debe abordar problemáticas reales que enfrentan tanto profesionales de la salud como pacientes y sus familias. Este criterio asegura que la pregunta no solo tenga aplicabilidad práctica, sino que también contribuya a la mejora continua de la atención clínica. Identificar áreas de dificultad permite desarrollar preguntas que aporten soluciones prácticas.
- Se generan a partir del pensamiento crítico sobre creencias preconcebidas y cuestionan las suposiciones. La capacidad de cuestionar supuestos previos y desafiar creencias establecidas es clave en la elaboración de preguntas significativas. La reflexión crítica sobre experiencias clínicas pasadas, junto con la revisión de contextos cambiantes, permite actualizar enfoques previos, adaptar modelos teóricos existentes y explorar nuevas líneas de investigación. Este proceso fomenta la innovación y la ampliación de marcos interpretativos en el ámbito clínico.
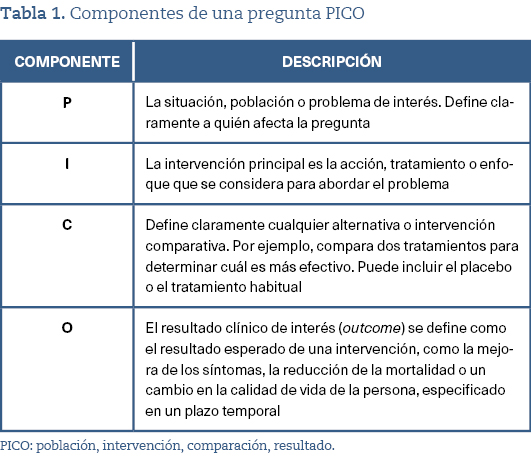
Para estructurar los dilemas de forma clara y enfocada, se suele utilizar el modelo PICO (población, intervención, comparación, resultado)18. Esta estructura facilita el desglose de los elementos clave de la pregunta y asegura que sea relevante y fácilmente investigable (tabla 1).
Selección de la evidencia. Revisión de la literatura y análisis crítico de la literatura científica
La localización de la mejor evidencia disponible, en numerosas ocasiones, representa un auténtico desafío debido a las numerosas y diversas fuentes de información existentes19. Para abordar este reto, es esencial formular una pregunta clínica precisa y utilizar las fuentes de información de manera eficiente. La selección de las variables clave en dicha pregunta guía los criterios de inclusión y exclusión en la búsqueda y orienta sobre la perspectiva de profesionales y pacientes sobre el fenómeno en cuestión. Además, el tipo y la estructura de la pregunta clínica facilitan la realización de una búsqueda más eficiente y enfocada en obtener evidencia relevante.
Es crucial examinar de forma cuidadosa los estudios, identificando posibles sesgos, inconsistencias o limitaciones, ya que no toda la información publicada es necesariamente aplicable. Este proceso exige apertura intelectual y disposición para considerar enfoques innovadores o perspectivas poco exploradas. Una actitud escéptica y analítica permite detectar vacíos en el conocimiento, reconocer controversias y delimitar con mayor claridad las áreas que requieren investigación adicional. Esta mirada crítica contribuye a fundamentar de forma más robusta cualquier recomendación, sobre todo al estar orientadas a desalentar prácticas clínicas que no aportan beneficios significativos o que pueden conllevar riesgos innecesarios.
La elección del diseño de investigación más adecuado debe responder con precisión a la pregunta clínica planteada20, ya que no todos los enfoques metodológicos ofrecen el mismo nivel de evidencia ni la misma aplicabilidad. También debe considerarse la relevancia clínica de los resultados, así como el tipo de desenlace medido, incluyendo tanto los resultados objetivos como aquellos informados directamente por pacientes, que aportan una visión más completa sobre la efectividad y la experiencia asociada a las intervenciones en salud.
Tómese como ejemplo las guías de práctica clínica (GPC). Este tipo de documento recopila recomendaciones desarrolladas sistemáticamente con el objetivo de asistir tanto a profesionales como a pacientes en la toma de decisiones, para así mejorar la calidad de la atención sanitaria en condiciones específicas21. Al desarrollar una recomendación en una GPC, se describen de forma detallada los métodos utilizados. Por ello, la descripción suele incluir además el proceso de selección de quienes integran el grupo, la revisión de la evidencia, el análisis y la formulación de recomendaciones22. El objetivo fundamental es, por lo tanto, elaborar una información en la que «se pueda confiar».
De igual manera, en la elaboración de una recomendación «no hacer» debería considerarse una estrategia igualmente sistemática, explícita y reproducible, a la vez que optimizada para maximizar el uso eficiente del tiempo y los recursos disponibles. Un paso fundamental para optimizar la estrategia de búsqueda podría consistir en iniciar la revisión de literatura con fuentes de evidencia secundaria. Estas fuentes, como las GPC y/o las revisiones sistemáticas preexistentes, proporcionan una perspectiva integral sobre el conocimiento actual y contribuyen a identificar áreas con incertidumbre o falta de evidencia. Este enfoque permitiría enfocar la búsqueda en aquellos aspectos que han sido investigados de manera exhaustiva, asegurando que la recomendación no solo esté alineada con las necesidades reales del campo, sino que además proporcione respuestas vinculadas al estado del conocimiento actual. De esta forma, la estrategia se optimiza en términos de recursos y se orienta de manera clara y precisa sobre el estado del conocimiento. En este sentido, se debe llevar a cabo una estrategia que busque exhaustivamente la mejor evidencia externa para responder a las preguntas clínicas20,23, que pueda seleccionar estudios originales ya evaluados para optimizar los recursos24 y que esté alineada con los requerimientos de Guía Salud, de modo que se prioricen los documentos de alta calidad científica y que hayan utilizado una metodología explícita, y en los que se indiquen los métodos de búsqueda, selección y evaluación de la evidencia científica (GPC, revisiones sistemáticas)25.
El desarrollo de una recomendación clínica «no hacer» requiere una evaluación rigurosa de la evidencia científica, así como la integración crítica de los resultados obtenidos en la búsqueda bibliográfica. Sistemas como GRADE se centran en la calidad de la evidencia, la certeza sobre los resultados, la variabilidad en los valores y las preferencias de las personas involucradas y el uso racional de los recursos26. Siguiendo este modelo, la certeza de la evidencia no la discrimina únicamente el diseño de investigación empleado, sino la calidad del estudio. Así se hace necesario evaluar la presencia de sesgos, imprecisión en los resultados, ausencia de evidencia directa y/o inconsistencia en los resultados27. Para decidir si los efectos indeseables superan claramente a los deseables, se ha de comparar el balance neto entre las alternativas terapéuticas. Para ello se debería analizar la magnitud de los efectos de la intervención, considerando tanto beneficios como daños, a través de medidas como el riesgo relativo (RR), reducción absoluta del riesgo (RAR) y número necesario a tratar o dañar (NNT/NND). La intervención será desaconsejable si los beneficios son mínimos o inciertos frente a riesgos clínicamente relevantes. Por último, se debería considerar a su vez aspectos como la aceptabilidad, la equidad y/o la factibilidad de la recomendación desde la perspectiva de pacientes y profesionales. Una intervención eficaz puede no ser aceptable o viable si su aplicación conlleva barreras éticas, sociales o si no implica un uso racional de los recursos.
Toma de decisiones basada en la evidencia
Una toma de decisiones basada en la evidencia radica en la integración de la mejor evidencia científica obtenida a través de la investigación, los conocimientos teóricos y prácticos de profesionales, así como los valores y circunstancias particulares de cada paciente20. Su objetivo es proporcionar una base sólida para la toma de decisiones clínicas informadas, fundamentadas en datos objetivos, y adaptadas a las necesidades individuales.
Este proceso incluye la validación de pruebas diagnósticas y la exploración física, así como la determinación de la potencia de los marcadores pronósticos. Además, se enfoca en evaluar la eficacia y la seguridad de estrategias terapéuticas y rehabilitadoras, así como de medidas preventivas. Todo esto se logra a través de la investigación aplicada tanto en la ciencia básica como en la clínica centrada en la persona. La integración de los conocimientos teóricos y prácticos de cada profesional es un componente clave en la práctica basada en la evidencia. Este enfoque implica un diagnóstico específico de cada paciente, considerando los riesgos y beneficios de las intervenciones disponibles en cada caso concreto. Para la toma de decisiones deben tenerse en cuenta los valores y preferencias de la persona, integrando sus preocupaciones, expectativas y decisiones en el proceso de toma de decisiones compartidas. Las circunstancias clínicas y el entorno en el que se encuentra cada paciente también son factores determinantes que influyen en las decisiones clínicas, asegurando que las intervenciones sean lo más pertinentes y beneficiosas posibles para cada individuo.
El uso de evidencia científica debe ser consciente, explícito y juicioso, basándose en datos válidos y disponibles procedentes de la investigación27. Es fundamental comprender los diferentes niveles de evidencia, ya que esto permitirá valorar de manera adecuada las intervenciones y sus resultados. La calidad de la evidencia refleja el grado de confianza que se puede depositar en los resultados obtenidos, lo que influye directamente en las recomendaciones clínicas27.
Al desarrollar directrices clínicas, las conclusiones respaldadas por la mejor evidencia científica deben prevalecer sobre las basadas solo en juicios subjetivos o experiencias aisladas. No obstante, es esencial reconocer que la evidencia empírica a menudo presenta limitaciones, y cuando las personas expertas lleguen a conclusiones que no se alineen con la evidencia disponible, es necesario explicar con claridad los motivos para apartarse de ella. Del mismo modo, aunque la investigación sobre la efectividad de las intervenciones y las GPC son fundamentales para orientar la toma de decisiones, no resuelven por completo los complejos debates éticos y políticos inherentes a la prestación de servicios de salud. Las decisiones deben considerar una variedad de factores, incluyendo juicios políticos, normas culturales, consideraciones económicas y las preferencias e intereses de las personas involucradas, lo que plantea limitaciones en la aplicación de la evidencia científica en contextos reales.
Características de una recomendación «no hacer»
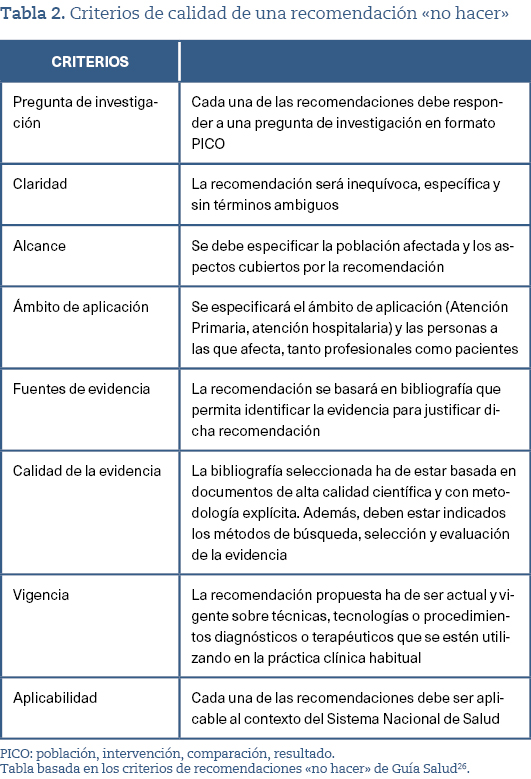
En el momento actual, Guía Salud es el organismo del Sistema Nacional de Salud que ha establecido los criterios de calidad que debería cumplir una recomendación «no hacer» en el contexto español. Así, cada una de las recomendaciones que se elaboren deben cumplir las características que se especifican en la tabla 2.
Discusión
En este artículo se ha descrito el contexto en el que surgen las recomendaciones «no hacer» y la metodología necesaria para su confección. Sin embargo, cabría hacer una reflexión del sentido de su implementación y del impacto que tienen en la práctica clínica y en los diferentes sistemas de salud. A fin de cuentas, la elaboración de estas recomendaciones tiene como objetivo mejorar la calidad asistencial y eliminar las PBV.
En el contexto español, Essencial es un organismo dependiente de la Agència de Qualitat i Avaluació Sanitàries de Catalunya (AQuAS). Su misión es promover una práctica clínica que evite la realización de prácticas que no aporten valor a la ciudadanía y que mejore la calidad de la atención sanitaria. En 201428 realizó un informe en el que evaluaba el impacto de sus recomendaciones del año 2009 al 2013. Para entonces contaban con un total de 29 recomendaciones de todas las especialidades médicas. Para garantizar un adecuado impacto, se organizó una campaña de difusión mediante sesiones formativas, así como medios digitales, llegando a un total de 4.000 profesionales de la salud. Algunos de los resultados obtenidos tras estas sesiones y la implementación de algunas de las recomendaciones a lo largo de ese período fueron: reducción del consumo del 5% de inhibidores de la bomba de protones (IBP), el 28% de antinflamatorios no esteroideos (AINE) y el 28% de bifosfonatos en mujeres con bajo riesgo de fractura. La traducción en términos económicos fue el ahorro de alrededor de 16 millones de euros.
Estados Unidos, impulsor de las recomendaciones «no hacer» a través de la iniciativa Choosing Wisely, ha visto mejoras en algunos aspectos de su sistema gracias a ellas. En el año 2021 se realizó una revisión sistemática29 para hacer una evaluación del impacto de las intervenciones de bajo valor en el contexto estadounidense, y una de las conclusiones más destacadas de esta revisión fue que la simple difusión de las guías Choosing Wisely, sin intervenciones asociadas, más allá de hacer las recomendaciones accesibles al personal, es improbable que contribuya a la reducción de las PBV en los sistemas sanitarios. La revisión encontró, además, que los estudios que empleaban intervenciones con un solo componente obtenían peores resultados en la reducción de PBV, en comparación con aquellos que utilizaban intervenciones multicomponente. Es decir, las intervenciones que abordan de manera simultánea varios elementos y actores dentro de una sola estrategia fueron significativamente más efectivas al implementar recomendaciones de las Choosing Wisely. Es más, la probabilidad de alcanzar los resultados esperados aumentaba cuando estas intervenciones multicomponente incluían elementos como consejos de comportamiento dirigidos a profesionales, revisiones clínicas, programas de formación o la creación de nuevas vías asistenciales. En particular, las estrategias orientadas a generar cambios organizativos que facilitaran la implementación de las recomendaciones de Choosing Wisely o aquellas que involucraban a profesionales de distintas disciplinas resultaron ser las más exitosas, a pesar de su mayor complejidad. Esto señala la necesidad de no solo crear evidencia científica que apoye la reducción de las PBV y su diseminación en forma de recomendaciones «no hacer», sino de cambios estructurales que vayan más allá de la responsabilidad individual de cada profesional para que tengan impacto real.
Como se observa tanto en el contexto español como estadounidense, la eliminación de PBV permite mejorar la calidad asistencial y, en términos de eficiencia, ahorrar millones de euros. Pero cabría preguntarse, las dificultades que se pueden encontrar con cada paciente a la hora de su implementación. En el caso del territorio español, no hay estudios que permitan analizar este aspecto. Sin embargo, en Estados Unidos un estudio mixto analizó si introducir recomendaciones «no hacer» tenía un impacto negativo en la relación entre profesionales y pacientes30. Una de las conclusiones que cabe destacar de este artículo es que la mayoría de pacientes enfatizó que los impactos negativos por la aplicación de recomendaciones «no hacer» podrían mitigarse si el o la profesional de la salud les escuchara, les dedicara tiempo y les ofreciera consejos comprensibles para poder evitar el uso de PBV.
Un enfoque exclusivamente biomédico carece de un marco que incorpore la visión de quienes se atiende sobre su estado de salud. Desde la perspectiva de un modelo de ACP, la inclusión de la visión de las/los pacientes, tanto en la producción de la investigación como en la toma de decisiones relacionadas con su salud, permite su participación activa, en lugar de mantener su rol de personas receptoras pasivas31. Medir lo que realmente importa al paciente se reconoce como un aspecto central para mejorar tanto la calidad asistencial como la prestación de servicios; sin embargo, para ello es fundamental su participación activa en la definición de qué se debe medir y cómo hacerlo32. Esto puede ser utilizado para generar evidencia sobre los beneficios y riesgos de las intervenciones terapéuticas desde la perspectiva de quienes reciben la atención, lo que está adquiriendo una relevancia creciente porque permite mejorar los resultados clínicos33.
El desarrollo de indicadores de calidad que evalúen de forma multidimensional la experiencia de cada paciente y el grado de concordancia entre la atención recibida y sus propios objetivos de salud resulta fundamental, especialmente en contextos de multimorbilidad y enfermedades avanzadas propios de la Atención Primaria (AP)34,25. De hecho, se ha evidenciado que los PROM (patient-reported outcomes measures) pueden facilitar la implementación efectiva de la atención centrada en la persona36. Al integrarlos en la práctica clínica, el personal sanitario puede tener una comprensión más profunda de las perspectivas individuales de cada persona que atiende, optimizar la comunicación clínica y, en última instancia, mejorar la adherencia terapéutica y los resultados en salud37.
La incorporación de los PROM en la formulación de recomendaciones del tipo «no hacer» podría potenciar la comunicación entre personal clínico y pacientes en relación con las distintas opciones terapéuticas, fomentando la toma de decisiones compartida y empoderando a las personas en su proceso asistencial, reduciendo así la brecha entre las perspectivas desde el rol profesional y desde quienes atraviesan el proceso de atención, y reforzando la ACP38-40. El avance de la MFyC hacia una toma de decisiones basada en la evidencia y centrada en la persona exige una mayor producción de conocimiento sobre la evolución de las preferencias, valores y expectativas de la población atendida41.
Conclusiones
La inclusión de las recomendaciones «no hacer» surge como una oportunidad de fomentar la toma de decisiones centrada en la persona y basada en la evidencia, reduciendo las PBV y los riesgos de las intervenciones. La inclusión de las preferencias, valores y expectativas de la población atendida podría ayudar a determinar la mejor manera de satisfacer las futuras necesidades de la AP y fomentar la participación de pacientes, manteniendo un enfoque alineado con valores como el compromiso con la persona.
Conflicto de intereses
Las autoras y el autor de este artículo declaran no tener conflictos de intereses.